Cu(NO3)2 – это химическое соединение из группы нитратов, состоящее из катиона меди и аниона нитрата. Оно имеет химическую формулу Cu(NO3)2 и молярную массу 187,55 г/моль.
Один из основных особенностей Cu(NO3)2 – его ярко-синий цвет. Кроме того, это соединение обладает высокой растворимостью в воде, что делает его удобным для использования в различных химических процессах и реакциях.
Свойства Cu(NO3)2 также включают его способность образовывать кристаллические структуры и формировать гидраты. При нагревании Cu(NO3)2 до 150 градусов Цельсия он начинает терять молекулы воды, образуя такие соединения, как Cu(NO3)2·2H2O и Cu(NO3)2·6H2O.
Применение Cu(NO3)2 широко разнообразно. Оно используется в различных отраслях промышленности и научных исследованиях. Например, Cu(NO3)2 применяется в электрохимии для получения токопроводящих пленок меди, в сельском хозяйстве как удобрение, а также в фотографии и красителях для окрашивания стекла и керамики.
Химический состав Cu(NO3)2
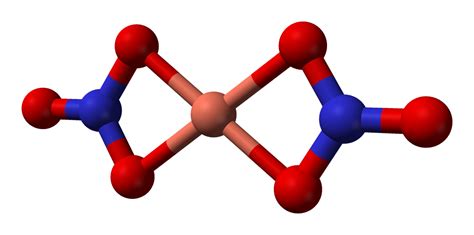
Молекула Cu(NO3)2 состоит из одного атома меди (Cu) и двух групп нитратных ионов (NO3). Каждый нитратный ион содержит один атом азота (N) и три атома кислорода (O).
Медь (Cu) представляет собой благородный металл с атомным номером 29 в периодической системе элементов. Он имеет серебристо-красный цвет и отличается высокой электропроводностью и теплопроводностью. Медь является важным элементом в различных промышленных отраслях, включая электротехнику, строительство и производство монет.
Нитрат (NO3) является отрицательно заряженным ионом. Он состоит из атома азота (N), находящегося в центре, и трех атомов кислорода (O), расположенных вокруг него. Нитратные соединения широко используются в промышленности и сельском хозяйстве, включая производство удобрений и взрывчатых веществ.
| Элемент | Атомный номер |
|---|---|
| Медь (Cu) | 29 |
| Азот (N) | 7 |
| Кислород (O) | 8 |
Физические свойства Cu(NO3)2
Сульфат меди(II) хорошо растворим в воде, образуя голубую или синюю окраску раствора. Он также растворим в других положительных растворителях, таких как метанол, этанол и глицерин.
Сульфат меди(II) не растворяется в эфире, бензоле и нескольких других органических растворителях.
Сульфат меди(II) обладает слабой кислотностью и может растворяться в щелочной среде.
Химические свойства Cu(NO3)2

- Растворимость: Cu(NO3)2 хорошо растворим в воде, образуя голубую прозрачную жидкость. Растворы Cu(NO3)2 обладают кислой реакцией.
- Окислительные свойства: Cu(NO3)2 является сильным окислителем. Оно может окислять многие вещества, например, металлы, аммиак и другие органические соединения.
- Термическое разложение: При нагревании Cu(NO3)2 разлагается, образуя оксид меди(II), оксид азота и кислород. Выделение кислорода может привести к возгоранию органических веществ.
- Реакция со щелочью: Cu(NO3)2 реагирует с щелочью, например, гидроксидом натрия или гидроксидом калия, образуя осадок гидроксида меди(II).
Химические свойства Cu(NO3)2 делают его полезным для различных приложений. Например, используется в процессе гальванопластики для нанесения покрытия медью на различные поверхности. Также Cu(NO3)2 используется в производстве красителей и пигментов, а также как катализатор в химической промышленности.
Применение Cu(NO3)2
- Электропроводность: Купрат(II) нитрат является электролитом и может использоваться в процессе электролиза, в электроплатах, а также при производстве батарей.
- Химические реакции: Cu(NO3)2 может использоваться в качестве катализатора при различных химических реакциях, таких как оксидация органических соединений.
- Цветной катализатор: Благодаря своим свойствам купрат(II) нитрат используется в качестве катализатора в различных химических процессах, включая синтез органических соединений.
- Медицина: Купрат(II) нитрат может использоваться в медицинских препаратах, в том числе применяться для лечения бактериальных инфекций, так как обладает антисептическими свойствами.
- Окрашивание: Cu(NO3)2 может быть использован в живописи и окрашивании для придания материалам желаемого цвета.
Таким образом, Cu(NO3)2 имеет широкий спектр применения, и его свойства и состав позволяют использовать его в различных отраслях науки и промышленности.
Опасность и меры предосторожности

При попадании Cu(NO3)2 на кожу или в глаза необходимо немедленно промыть область холодной водой в течение нескольких минут. При возникновении раздражения или зуда следует обратиться к врачу.
При попадании Cu(NO3)2 внутрь организма необходимо сразу же промыть рот водой и немедленно обратиться к врачу.
Работа с Cu(NO3)2 должна происходить в хорошо проветриваемых помещениях или с использованием специального вытяжного оборудования, чтобы избежать ингаляции паров вещества.
Необходимо использовать перчатки и защитные очки при работе с Cu(NO3)2, чтобы предотвратить контакт с кожей и глазами.
Хранение Cu(NO3)2 следует осуществлять в хорошо закрытой упаковке вне досягаемости детей и животных.
В случае пожара необходимо использовать средства индивидуальной защиты и эвакуироваться из опасной зоны. Не следует применять воду для тушения пожара, так как это может способствовать распространению испарений и созданию еще большей опасности.
Взаимодействие Cu(NO3)2 с другими химическими соединениями
Фосфат меди(II), Cu3(PO4)2, взаимодействует с Cu(NO3)2 и образует сложное соединение Cu3(PO4)2·2Cu(NO3)2·3H2O. Этот осадок обладает зеленовато-голубым цветом и может использоваться в процессе окрашивания тканей и кожи.
Оксиды меди также взаимодействуют с Cu(NO3)2. Например, в результате реакции Cu(NO3)2 с CuO образуется медный нитрат и вода. Это служит основой для получения нитратных соединений меди.
Другим важным взаимодействием является реакция Cu(NO3)2 с гидроксидом натрия, NaOH, при которой образуется осадок гидроксида меди(II), Cu(OH)2. Это соединение является важным компонентом в производстве пигментов и косметических средств.
| Реагент | Реакция |
|---|---|
| CuSO4 | [Cu(NO3)2(H2O)2]2+Cu(H2O)6] |
| Cu3(PO4)2 | Cu3(PO4)2·2Cu(NO3)2·3H2O |
| CuO | Mедный нитрат + H2O |
| NaOH | Cu(OH)2 |
Переработка и утилизация Cu(NO3)2

Одним из методов переработки Cu(NO3)2 является химическое восстановление, которое позволяет получить медь в недорогостоящей форме. При этом, Cu(NO3)2 вступает в реакцию с восстановителем, например, натрием, и образует медный осадок.
Еще одним методом переработки Cu(NO3)2 является электрохимическое осаждение, при котором происходит электролиз водного раствора Cu(NO3)2. В результате этого процесса, медь осаждается на катоде, а нитрат меди (II) остается в растворе.
После переработки Cu(NO3)2, полученные продукты и отходы требуют утилизации. Отходы, содержащие медь, могут быть использованы вторично в процессе производства меди или других металлов. Остатки, содержащие нитрат меди (II), могут быть обработаны для извлечения прочих ценных компонентов или нейтрализованы с целью безопасного удаления.
Правильная переработка и утилизация Cu(NO3)2 являются важными шагами для минимизации негативного воздействия на окружающую среду и обеспечения устойчивого развития промышленности.




