Химия – это одна из фундаментальных наук, изучающих строение вещества и изменения, которые оно может претерпеть. Одним из основных понятий химии является атом – неделимая частица вещества, которая обладает определенными свойствами и может соединяться с другими атомами для образования соединений.
Атомы состоят из трех основных элементов: протонов, нейтронов и электронов. Протоны имеют положительный электрический заряд и находятся в ядре атома, в то время как электроны имеют отрицательный заряд и обращаются по орбитам вокруг ядра. Нейтроны не имеют электрического заряда и также находятся в ядре.
Количество протонов в атоме определяет его химические свойства и называется атомным номером. Атомы различных элементов отличаются друг от друга по числу протонов в их ядре. Например, атом водорода имеет один протон, атом углерода – шесть протонов. Номер элемента в периодической системе Менделеева соответствует его атомному номеру.
Атомы – основные строительные единицы вещества

Протоны находятся в центральной части атома, называемой ядром. Они обладают положительным электрическим зарядом и определяют химические свойства элемента. Количество протонов в ядре определяет атомный номер элемента и его позицию в периодической таблице.
Нейтроны также находятся в ядре и не имеют заряда. Они помогают поддерживать стабильность ядра, снижая отталкивающее воздействие протонов.
Электроны движутся по орбитам вокруг ядра. Они обладают отрицательным электрическим зарядом и притягиваются к положительно заряженному ядру. Количество электронов в атоме определяет его электрическую нейтральность.
Атомы различных элементов могут объединяться, образуя молекулы. Молекула - это группа атомов, связанных между собой химическими связями. Знание о структуре и свойствах атомов позволяет ученым предсказывать химические реакции и создавать новые материалы и соединения.
Изучение атомов и их свойств является основой для понимания химических процессов и развития химии как науки. Оно помогает объяснить разнообразие свойств вещества и применить их в различных сферах жизни, таких как медицина, промышленность и технология.
Структура атома и его основные части
Протоны – это положительно заряженные частицы, которые находятся в ядре атома. Масса протона равна массе нейтрона и примерно в 1836 раз больше массы электрона. Количество протонов в атрое определяет его химические свойства и называется порядковым числом элемента.
Нейтроны – это нейтральные частицы, которые также находятся в ядре атома. Масса нейтрона такая же, как у протона. Количество нейтронов в атоме может варьироваться, образуя изотопы – разновидности атомов одного и того же элемента с разным количеством нейтронов.
Электроны – это отрицательно заряженные частицы, которые двигаются по орбитам вокруг ядра атома. Масса электрона очень мала по сравнению с массой протона и нейтрона. Количество электронов в атоме также определяет его химические свойства.
Обычно, число протонов в атоме равно числу электронов, что делает атом электрически нейтральным. Однако, если число электронов не совпадает с числом протонов, то атом будет иметь электрический заряд и называться ионом.
Таким образом, структура атома состоит из ядра, содержащей протоны и нейтроны, и электронной оболочки, в которой движутся электроны. Изменение числа этих частиц и их распределение определяет различные химические свойства элементов и формирование химических соединений.
Химические элементы и их атомы
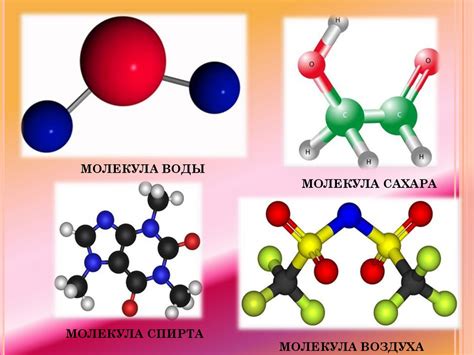
Протоны имеют положительный электрический заряд, нейтроны не имеют заряда, а электроны имеют отрицательный заряд. Протоны и нейтроны находятся в ядре атома, а электроны обращаются вокруг ядра по орбитам.
Количество протонов в атоме определяет его атомный номер и определяет химические свойства элемента. Например, атом с одним протоном - это атом водорода, атом с шестью протонами - это атом углерода.
Помимо протонов, число нейтронов в атоме также может варьироваться. Атомы одного и того же элемента с разным числом нейтронов называют изотопами. Изотопы имеют один и тот же атомный номер, но различное массовое число.
Электроны обладают наименьшей массой из всех элементарных частиц атома. Они находятся на разных энергетических уровнях, называемых орбитами. Количество электронов на каждой орбите определяет электронную конфигурацию атома и его химические свойства.
Атомы формируют химические соединения, соединяясь друг с другом по определенным правилам. Химические соединения образуются путем обмена, передачи или совместного использования электронов, что позволяет элементам стабилизировать свои энергетические уровни и образовывать более устойчивые структуры.
Таким образом, понимание атомов и их характеристик является основой для понимания химии и ее различных аспектов, таких как химические реакции, соединения и свойства веществ.
Открытие атома и его роль в химических реакциях
Идея о существовании атома, как неделимой частицы материи, возникла в древней Греции благодаря работы Демокрита. Однако, понимание его структуры и свойств развивалось на протяжении многих столетий. В конце XIX века, благодаря открытиям Жозефа Джона Томсона и Эрнеста Резерфорда, наука получила более четкое представление о строении атома.
Атомы играют важную роль в химических реакциях. За счет взаимодействия атомов, происходят химические превращения, в результате которых образуются новые вещества. Реакции могут протекать с участием одного вида атомов или с участием нескольких видов атомов.
Взаимодействие атомов в химической реакции обусловлено их электронной структурой, т.е. распределением электронов на различных энергетических уровнях. Изменение взаимного расположения электронов в атомах приводит к образованию новой связи между атомами и, как следствие, к образованию нового химического вещества.
Понимание роли атомов в химических реакциях позволило развить химическую науку и применить ее в различных областях жизни, от производства материалов и лекарств до создания новых энергетических источников. Практически все, с чем мы сталкиваемся в повседневной жизни, является результатом взаимодействия и преобразования атомов.
Основные характеристики атома: заряд и масса
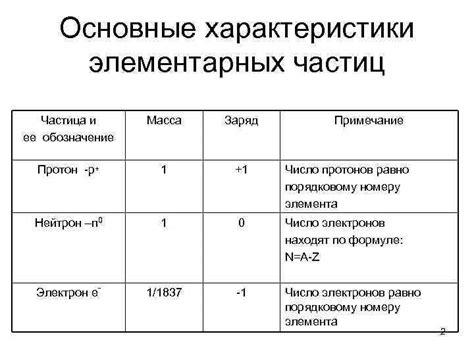
Заряд атома – это электрическая характеристика, которая определяет его взаимодействие с другими атомами и молекулами. Заряд атома может быть положительным, отрицательным или нейтральным. Положительный заряд атома означает, что он имеет избыточное количество протонов (положительно заряженных частиц) по сравнению с электронами (отрицательно заряженные частицы) внутри его ядра. Отрицательный заряд атома означает, что он имеет лишние электроны, а нейтральный заряд означает, что протоны и электроны в атоме равны по количеству.
Масса атома – это физическая характеристика, которая определяет его вес и инертность. Масса атома определяется суммарной массой всех его частиц, включая протоны, нейтроны и электроны. Масса атома измеряется в атомных единицах массы (а.е.м), где 1 а.е.м равна массе одного атома углерода-12. Отличие массы атомов разных элементов обусловлено различным количеством протонов и нейтронов в их ядрах.
Понятие о химическом соединении и его связь с атомами
Химическое соединение представляет собой вещество, образованное химической комбинацией двух или более атомов различных элементов. Один атом не может образовать химическое соединение, поэтому существование соединений в химии неразрывно связано с атомами.
Атомы входят в химические соединения через химические связи. Часто на атомах есть свободные электроны, которые привлекаются к другим атомам с целью создания стабильной структуры. Такие связи называются ковалентными связями. Другой тип связи - ионная связь - возникает между атомами с различными зарядами. Атомы, образующие ионную связь, становятся ионами и притягиваются друг к другу благодаря их противоположным зарядам.
Важно понимать, что химические связи не только объединяют атомы, но и определяют их свойства и реакционную способность. Силы этих связей могут быть разными, что влияет на степень устойчивости соединений и их химическую активность. Чем крепче связь между атомами, тем более стабильным будет соединение. А наоборот, если связь слабая, соединение может быть химически нестабильным и легко распадаться.
Знание о структуре химических соединений и связях между их атомами важно для понимания многих явлений и процессов, происходящих в химических системах. Изучение атомов и их взаимодействия в химических соединениях является основой химической науки и позволяет расширить знания о мире вокруг нас.




