Аллотропия является явлением, когда один и тот же химический элемент может образовывать различные структуры и агрегатные состояния. В результате этого возникают различные модификации элемента, называемые аллотропами. Эти различия могут заключаться в разной кристаллической структуре, молекулярном строении или физических свойствах.
Аллотропия широко распространена в химии и физике и может быть наблюдаема у многих элементов, таких как углерод, кислород, фосфор, сера и другие. Каждый аллотропный вид обладает своими уникальными свойствами и способностью формировать различные химические связи.
В рамках аллотропии существуют различные виды химической связи, включая координационную связь, ковалентную связь и ван-дер-ваальсову связь. Координационная связь возникает, когда один атом образует связь с другим атомом, предоставляя пару электронов. Ковалентная связь образуется при совместном использовании электронной пары двумя атомами. Ван-дер-ваальсова связь является слабой электростатической связью, возникающей между молекулами или атомами.
В статье будут рассмотрены различные аллотропные формы нескольких химических элементов и особенности химической связи между атомами в этих структурах. Также будет обсуждаться влияние аллотропии на физические и химические свойства этих элементов.
Аллотропия - понятие и его основные виды

Основными видами аллотропии являются:
1. Диамант - аллотропный вид углерода, который представляет собой кристаллическую структуру соединений углерода. Диаманты обладают очень высокой твердостью и являются одним из самых твердых материалов.
2. Графит - другая форма углерода, отличающаяся от диаманта своей структурой. Графит представляет собой слоистую структуру, в которой атомы углерода расположены в плоскостях. Графит имеет мягкую текстуру и используется в карандашах.
3. Графен - один из наиболее известных аллотропов углерода, представляющий собой однослойный графит. Графен обладает уникальными электронными свойствами и используется в различных областях, таких как электроника и нанотехнологии.
4. Озон - молекулярная форма кислорода, состоящая из трех атомов. Озон является сильным окислителем и используется в промышленности и медицине.
Аллотропия является одной из основных причин разнообразия свойств элементов и открывает новые возможности для использования материалов в различных технологиях и отраслях науки.
Что такое аллотропия и в чем ее значение?
Важно понимать, что аллотропия может проявляться как у металлов, так и у неметаллов, и играет важную роль в областях, таких как материаловедение и нанотехнологии.
Если говорить о химической связи в аллотропии, то она может быть как металлической, так и ковалентной. В случае металлической связи, атомы металла образуют кристаллическую решетку, где свободные электроны перемещаются между атомами.
В случае ковалентной связи, атомы неметалла образуют сильные связи через обмен электронами. Различные формы аллотропии могут иметь разное количество электронных связей, что влияет на их свойства.
Особое значение аллотропии заключается в том, что она позволяет улучшить или изменить свойства вещества, что делает его полезным в различных областях применения, включая производство материалов, электронику, катализ и многие другие.
Первый вид химической связи в аллотропии: ковалентные связи
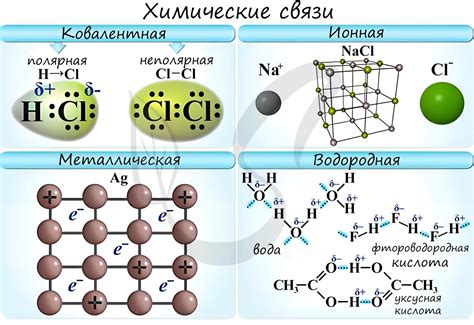
Ковалентные связи могут быть одиночными, двойными или тройными, в зависимости от того, сколько электронных пар обменивают атомы. В аллотропии могут быть образованы различные типы ковалентных связей в зависимости от конкретной структуры аллотропной формы.
| Аллотропная форма | Ковалентная связь |
|---|---|
| Графит | Сетчатая структура с одними одиночными и другими двойными ковалентными связями. |
| Алмаз | Сетчатая структура с только одиночными ковалентными связями. |
| Фуллерены | Сферическая структура с ковалентными связями между атомами углерода. |
| Графен | Двухмерная структура с ковалентными связями между атомами углерода в гексагональной решетке. |
В целом, ковалентные связи в аллотропии определяют структуру и свойства различных аллотропных форм элементов. Изучение этих связей позволяет углубить наше понимание химических и физических свойств аллотропных веществ.
Второй вид химической связи в аллотропии: металлические связи
Металлические связи являются необычными, так как они не ограничены между конкретными атомами, а распространяются по всем металлическому кристаллу. В результате этого металл становится проводником электричества и тепла.
Электроны, участвующие в металлической связи, могут двигаться свободно по кристаллической решетке, что объясняет способность металлов проводить электрический ток. Также именно из-за свободного движения электронов металлы обладают хорошей теплопроводностью и отличаются от других материалов.
Основные свойства металлических связей в аллотропии:
- Проводимость электричества. Металлы могут проводить электрический ток, так как электроны могут свободно двигаться по кристаллической решетке.
- Высокая теплопроводность. Металлы могут эффективно передавать тепло благодаря свободному движению электронов.
- Пластичность и формоизменяемость. Металлы могут легко подвергаться деформации без разрушения, так как связи между атомами в металлической решетке не являются ковалентными или ионными.
- Металлические связи могут образовываться как между атомами одного и того же металла (гомологичные металлы), так и между атомами разных металлов (гетерологичные металлы).
Металлические связи являются важным аспектом аллотропии, так как они определяют многие физические свойства металлов. Понимание этих связей позволяет лучше понять структуру и свойства различных аллотропических форм металлов.
Третий вид химической связи в аллотропии: ионные связи
Ионные связи характерны для таких форм аллотропии, как солям, окислам и металлическому аллотропу. В солях и окислах ионные связи образуются между ионами с противоположными зарядами. Например, в хлориде натрия (NaCl), один атом натрия образует положительный ион Na+, а один атом хлора образует отрицательный ион Cl-. Ионные связи между ними притягивают эти ионы друг к другу, образуя кристаллическую решетку.
В металлическом аллотропе, ионные связи образуются между металлическими ионами. Этот вид связи отличается от связи в солях и окислах, так как металлические ионы отдельно не образуют кристаллическую решетку, а располагаются в металлической матрице, где они могут двигаться свободно, образуя электронное облако. Металлическая связь существует между положительно заряженным ядром и облаком электронов, что обеспечивает высокую проводимость электричества и тепла в металлах.




