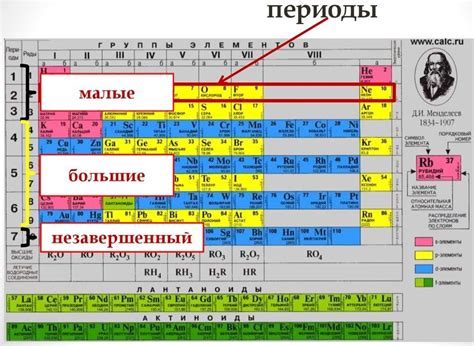
В таблице Менделеева элементы химических элементов организованы в определенном порядке, который отражает множество закономерностей и принципов химии. Основными структурными элементами этой таблицы являются периоды. Периоды представляют собой горизонтальные строки, каждая из которых содержит определенное количество элементов.
Периоды в таблице Менделеева имеют различное количество элементов. Первый период состоит только из двух элементов - водорода и гелия. Второй период содержит восемь элементов, начиная с лития и заканчивая неоном. Третий период содержит 8 элементов, и так далее. Каждый последующий период имеет на один элемент больше, чем предыдущий.
Каждый период в таблице Менделеева имеет свое значение и отражает особенности строения электронной оболочки атомов элементов. На самом деле, периоды отображают количество энергетических уровней, которые содержат электроны. В первом периоде электроны могут находиться только на первом энергетическом уровне, во втором периоде - на первом и втором энергетических уровнях, и так далее.
Таким образом, структура периодов в таблице Менделеева позволяет легко определить, сколько энергетических уровней содержит атом каждого элемента и, соответственно, его электронную конфигурацию. Периоды также отображают другие закономерности, например, изменение радиуса атомов в периоде и изменение их химических свойств.
Значение таблицы Менделеева
Каждый элемент в таблице Менделеева имеет свое уникальное положение, определенное его атомной структурой и химическими свойствами. Таблица Менделеева расположена в порядке возрастания атомного номера, что позволяет определить порядковый номер каждого элемента и его электронную конфигурацию.
Структура таблицы Менделеева состоит из строк и столбцов, которые образуют периоды и группы. Периоды горизонтально расположены и представляют собой уровни энергии, на которых находятся электроны в атоме. Группы вертикально расположены и показывают сходство в химических свойствах элементов.
Таким образом, таблица Менделеева является основой для понимания химических принципов и взаимодействий между элементами. Она помогает химикам и ученым предсказывать и исследовать новые элементы, разрабатывать новые соединения и материалы, а также понимать законы и закономерности в химии.
| Период | Количество элементов в периоде |
|---|---|
| 1 | 2 |
| 2 | 8 |
| 3 | 8 |
| 4 | 18 |
| 5 | 18 |
| 6 | 32 |
| 7 | 32 |
Периоды в таблице Менделеева
Таблица Менделеева представляет собой систематическое расположение химических элементов, основанное на их атомном номере, электронной конфигурации и химических свойствах. В таблице Менделеева элементы располагаются в порядке возрастания атомного номера, а также организованы в определенные горизонтальные ряды, называемые периодами.
Периоды в таблице Менделеева представляют собой строки, расположенные горизонтально. Всего в таблице Менделеева существует 7 периодов. Периоды отличаются друг от друга наличием различного количества электронных оболочек у элементов.
В первом периоде находятся элементы с одной электронной оболочкой, во втором периоде - элементы с двумя электронными оболочками, и так далее. Каждый следующий период начинается с первого элемента, имеющего новую электронную оболочку. Например, первый период начинается с водорода, у которого только одна электронная оболочка, второй период начинается с лития, у которого уже две электронные оболочки.
Периоды в таблице Менделеева также отличаются по размеру: первый период состоит только из двух элементов - водорода и гелия, второй период - из восьми элементов, третий период - из восьми элементов, и так далее. Общее количество элементов в каждом периоде определяется количеством электронных оболочек у элементов в этом периоде.
Важно отметить, что в таблице Менделеева имеются элементы, которые не могут быть расположены в соответствии с порядком атомного номера, а именно лантаниды и актиниды. Они размещаются в отдельные блоки под основной таблицей Менделеева и представляют собой периодическую систему элементов продолжительностью сразу несколько периодов.
| Период | Количество элементов | Примеры элементов |
|---|---|---|
| 1 | 2 | Нидроген, Гелий |
| 2 | 8 | Литий, Бериллий, Бор, Углерод, Кислород, Фтор, Неон |
| 3 | 8 | Натрий, Магний, Алюминий, Кремний, Фосфор, Сера, Хлор, Аргон |
| 4 | 18 | Калий, Кальций, Титан, Ванадий, Хром, Железо, Никель, Медь, Цинк, Галлий, Германий, Арсеник, Селен, Бром, Криптон, Рубидий, Стронций, Иттрий |
| 5 | 18 | Цирконий, Ниобий, Молибден, Технеций, Рутений, Родий, Палладий, Серебро, Кадмий, Индий, Олово, Сурьма, Теллур, Йод, Ксенон, Цезий, Барий, Лантан |
| 6 | 32 | Гафний, Тантал, Вольфрам, Рений, Осмий, Иридий, Платина, Золото, Ртуть, Таллий, Свинец, Висмут, Полоний, Астат, Радон, Франций, Радий, Актиний, Торий, Протактиний, Уран, Нептуний, Плутоний, Америций, Кюрий, Берклий, Калифорний, Уннилий, Фермий, Менделевий, Нобелий, Лоуренсий |
| 7 | 32 | Резерфордий, Дубний, Сиборгий, Борий, Хассий, Мейтнерий, Дармштадтий, Рентгений, Коперниций, Нихоний, Флеровий, Московий, Ливерморий, Теннессин, Оганесон, Нихоний, Морганеллий, Дармштадтий, Рентгений, Мейтнерий, Дубний, Сиборгий, Борий, Хассий, Коперниций, Нихоний, Фермиум, Менделевий |
Таким образом, периоды в таблице Менделеева позволяют организовать набор химических элементов в систематическую и удобочитаемую структуру, основанную на их атомных свойствах и электронной конфигурации.
Строение периода в таблице Менделеева
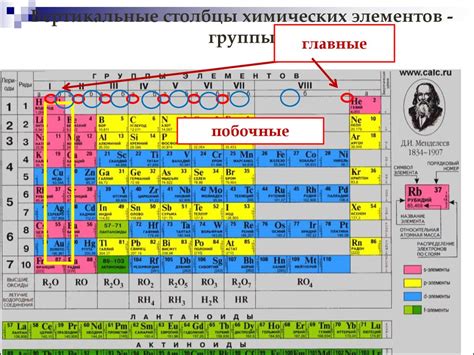
Периодическая система химических элементов, разработанная Дмитрием Ивановичем Менделеевым, представляет собой таблицу, где элементы расположены таким образом, что элементы схожих свойств находятся в одной вертикальной группе, а элементы схожих по размеру ядра расположены в одном горизонтальном периоде.
Периоды в таблице Менделеева представляют собой горизонтальные строки, обозначенные числами от 1 до 7. Каждый период начинается с щелочного металла и заканчивается инертным газом. Каждый новый период начинается с появления новой энергетической оболочки, добавляющейся к атомному ядру, что приводит к увеличению радиуса атомов.
Каждый период в таблице Менделеева имеет свою характеристику, и общее строение периодов включает следующие элементы:
- Щелочные металлы - элементы первой группы (например, литий, натрий, калий).
- Щелочноземельные металлы - элементы второй группы (например, бериллий, магний, кальций).
- Переходные металлы - элементы с 3 по 12 группы (например, железо, медь, цинк).
- Постпереходные металлы - элементы с 13 по 16 группу (например, алюминий, галлий, индий).
- Металлы главной подгруппы - элементы с 13 по 16 группы (например, кремний, свинец, бисмут).
- Неметаллы - элементы смежные с металлами главной подгруппы (например, фосфор, сера, селен).
- Инертные газы - элементы последней, 18-й группы (например, гелий, неон, аргон).
Строение периода в таблице Менделеева отражает регулярность и систематичность природных закономерностей химических элементов, позволяя предсказывать их свойства и взаимодействия с другими элементами.
Первый период
Водород - самый легкий и распространенный химический элемент во Вселенной. Атом водорода состоит из одного протона в ядре и одного электрона на орбите вокруг ядра. Водород можно встретить в различных формах, например в виде газа, жидкости или твердого вещества.
Гелий - второй по распространенности элемент во Вселенной после водорода. Атом гелия состоит из двух протонов в ядре и двух электронов на орбитах вокруг ядра. Гелий является инертным газом, т.е. он не образует химические соединения с другими элементами.
Первый период в таблице Менделеева представляет основу для построения более сложных элементов и играет важную роль в химических реакциях и соединениях.
Второй период

Литий и бериллий относятся к группе щелочных металлов и щелочноземельных металлов соответственно. Бор, углерод, азот, кислород, фтор и неон относятся к неметаллам. Элементы второго периода обладают различными свойствами и имеют важное значение в химии и промышленности.
Например, литий используется в производстве аккумуляторов, бериллий используется в производстве ядерного топлива, бор используется в производстве стекла и керамики, углерод является основой органических соединений, азот используется в производстве удобрений, кислород является необходимым для дыхания, фтор используется в производстве химических соединений, а неон используется в осветительной технике.
Второй период таблицы Менделеева отражает некоторые основные закономерности элементов и помогает понять строение и свойства других периодов. Количество элементов в периоде увеличивается с каждым новым периодом, а их свойства и химические реакции разнообразны и зависят от строения электронных оболочек.
Третий период
Третий период в таблице Менделеева состоит из 8 элементов, начиная с натрия (Na) и заканчивая аргоном (Ar). В этом периоде находятся атомы, у которых третий энергетический уровень заполнен.
Натрий (Na) является представителем первой группы третьего периода и имеет атомный номер 11. Он отличается от предыдущих элементов этого периода наличием внешней электронной оболочки, в которой находится всего один свободный электрон. Натрий активно реагирует с кислородом и водой, образуя оксид натрия (Na2O) и гидроксид натрия (NaOH).
После натрия в третьем периоде следуют магний (Mg), алюминий (Al), кремний (Si), фосфор (P), сера (S) и хлор (Cl). Эти элементы также характеризуются наличием третьего энергетического уровня. Они обладают свойствами металлов, полуметаллов и неметаллов и принадлежат различным группам таблицы Менделеева.
Аргон (Ar) является последним элементом третьего периода и имеет атомный номер 18. Аргон - неметалл инертный газ, чаще всего используется в заполнителях для ламп газоразрядных.




