Ионные уравнения являются основой для понимания химических реакций, происходящих в растворах. Они описывают, как ионы реагируют, формируются и превращаются друг в друга. Ионные уравнения обычно записываются в виде химических уравнений, но с определенными правилами, когда некоторые ионы отбрасываются, а другие остаются.
Один из ключевых моментов при записи ионных уравнений - это отбрасывание ионов, которые не претерпевают изменения во время реакции. Такие ионы называются спектаторными ионами. Они не участвуют в химической реакции напрямую и просто остаются в растворе без изменений. В этих уравнениях спектаторные ионы часто записываются в виде растворов, чтобы подчеркнуть, что они не меняются в процессе реакции.
Примером может служить реакция между серной кислотой и гидроксидом натрия. Ионное уравнение для этой реакции выглядит следующим образом:
H2SO4 + 2NaOH → 2H2O + Na2SO4
В этом уравнении спектаторными ионами являются Na+ и SO42-. Они находятся с обеих сторон уравнения и не производят новых веществ. Поэтому их можно отбросить и записать уравнение следующим образом:
H2SO4 + 2OH- → 2H2O + SO42-
Отбрасывание спектаторных ионов в ионных уравнениях помогает сделать уравнение более простым и ясным, так как фокусируется только на веществах, которые действительно меняются при реакции.
Катионы и анионы

Ионные уравнения представляют собой химические реакции, в которых ионы реагентов и продуктов указаны в виде их зарядов и агрегатных состояний. Они позволяют более точно описать процесс ионного обмена и выяснить, какие ионы присутствуют в реакции. В таких уравнениях нет информации о других компонентах, таких как растворители или вещества, не участвующие в реакции.
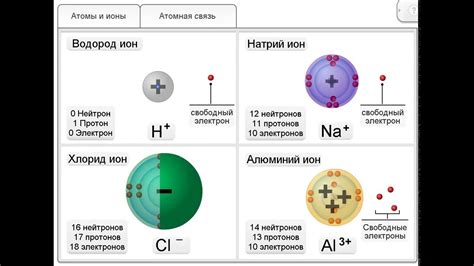
Катионы представляют собой положительно заряженные ионы, которые образуются от потери одного или нескольких электронов. Катионы называются так же на основе элемента, от которого они произошли. Например, для натрия (Na) катион будет обозначаться как Na+, а для калия (K) - K+. В ионных уравнениях катионы указываются с положительным знаком.
Анионы, напротив, представляют собой отрицательно заряженные ионы, которые образуются от приобретения одного или нескольких электронов. Анионы также называются на основе элемента, от которого они произошли, но с добавлением суффикса "-ид". Например, хлор (Cl) образует хлоридные анионы, обозначаемые как Cl-. В ионных уравнениях анионы указываются с отрицательным знаком.
Катионы и анионы являются ключевыми элементами ионных реакций, так как они являются основными носителями заряда и определяют свойства реакционных смесей. Их учет в ионном уравнении позволяет более полно описать происходящие процессы и с учетом этого проводить анализ и прогнозирование реакций.
Определение ионов
Ионные уравнения используются для представления химических реакций, в которых участвуют ионы. В этих уравнениях показываются все реагенты и продукты реакции, а также ионы, которые образуются или пропадают в результате реакции.
В ионном уравнении отбрасываются реагенты и продукты реакции, которые не изменяют своего состава и заряда. Например, воду (H2O) можно не показывать в ионном уравнении, так как она остается в неизменном состоянии и не образует ионов.
Однако, некоторые реагенты и продукты могут быть включены в ионное уравнение, если они изменяют свой заряд или образуют ионы. Например, кислород (O2) может быть показан в ионном уравнении, так как он может образовать ионы оксида (O2-).
Важно отметить, что в ионных уравнениях прописываются ионы, а не молекулы. Таким образом, ионные уравнения позволяют лучше понять, какие ионы взаимодействуют между собой и как происходит образование новых соединений.
Какие ионы отбрасываются?
В процессе записи ионного уравнения в химических реакциях некоторые ионы могут быть отброшены. Это происходит по нескольким причинам:
1. Реакционная способность иона. Некоторые ионы проявляют малую способность к реагированию и не участвуют в химической реакции. Они не меняются на противоположно заряженные ионы и остаются в растворе без изменений.
2. Ионы, находящиеся в том же агрегатном состоянии. Если все ионы в исходных веществах и реакционных продуктах находятся в одном агрегатном состоянии (например, все растворены в растворе или все в твердом состоянии), то такие ионы можно отбросить из ионного уравнения.
3. Ионы, участвующие в не существенных реакциях. Некоторые ионы могут участвовать в побочных реакциях, которые не играют существенной роли в данной реакции. В таких случаях можно отбросить эти ионы.
Важно отметить, что в некоторых случаях ионы, которые отбрасываются, все равно присутствуют в реакции, но не указываются в ионном уравнении для упрощения записи и понимания сути химической реакции.
Кислотно-основные реакции
В ходе кислотно-основных реакций ионы водорода (H+) присоединяются к основанию, образуя воду, а ионы гидроксида (-OH) присоединяются к кислоте, образуя также воду. Получающиеся соли обычно являются ионными соединениями, состоящими из ионов катиона, произошедшего от кислоты, и ионов аниона, произошедшего от основания.
Ионное уравнение для кислотно-основной реакции позволяет описать химический процесс на уровне ионов. В ионных уравнениях отражается перемещение ионов и их разрывание или образование новых химических связей. При этом часто отбрасываются ионы, не участвующие в реакции и не изменяющие своего состояния или степени окисления.
Например, в реакции между соляной кислотой и гидроксидом натрия, образующей хлорид натрия и воду, ионы натрия (Na+) и хлора (Cl-) не изменяются, поэтому их можно отбросить при записи ионного уравнения:
HCl + NaOH → NaCl + H2O
Такое упрощенное ионное уравнение позволяет более ясно описать химическую реакцию и увидеть, какие ионы участвуют в ней.
Протонные переносы
Протонные переносы в химических реакциях включают передачу протона от одного вещества к другому. Обычно протоны переносятся от способного отдавать протон вещества (донора) к способному принимать протон веществу (акцептору). Такой процесс может происходить в водных растворах или в присутствии других растворителей.
Примером протонного переноса является реакция между сильными кислотами и сильными основаниями, где ионы водорода в кислоте передаются к ионам гидроксида в основании:
HCl + NaOH → NaCl + H2O
В данном случае протон передается от кислоты (HCl) к основанию (NaOH), образуя хлорид натрия (NaCl) и молекулу воды (H2O).
Простейшим примером протонного переноса является автопротолиз воды, где одна молекула воды отдает протон другой молекуле воды:
H2O + H2O → H3O+ + OH-
В данной реакции одна молекула воды действует в качестве донора протона, а другая – в качестве акцептора. После переноса протона образуется гидроксоний (H3O+) и гидроксид (OH-). Такая система является сильным кислотным и сильным основным соответственно.
Исключение крайне важных, но не относящихся к ионному уравнению, протонных переносов может привести к неправильному представлению реакции и результата. Обратите внимание на протонные переносы при анализе химических реакций, так как они играют важную роль в понимании реакционного механизма и продуктов.
Гидроксидные ионы
Гидроксидные ионы образуются при диссоциации баз, таких как гидроксид натрия (NaOH), гидроксид калия (KOH) и гидроксид аммония (NH4OH). При контакте с водой, эти соединения распадаются на положительно заряженные ионы металла (натрий, калий, аммоний) и отрицательно заряженные гидроксидные ионы.
Гидроксидные ионы могут участвовать в реакциях с другими веществами. Например, они могут реагировать с кислотами, образуя нейтральные соли и воду. Также гидроксидные ионы могут взаимодействовать с катионами металлов, образуя осадки нерастворимых гидроксидов.
Гидроксидные ионы часто встречаются в природе. Например, гидроксидные ионы содержатся в растворах, образующихся при действии воды на месторождения минеральных руд и грунтовые воды. Они также могут быть синтезированы и использованы в лаборатории для проведения различных химических экспериментов и исследований.




