Электроны - это основные элементы атомов, которые образуют все вещество в нашей вселенной. Понимание того, как электроны двигаются вокруг ядра и как это влияет на характеристики вещества, является фундаментальным вопросом в физике. В этой статье мы рассмотрим основные принципы и характеристики движения электронов в атомах.
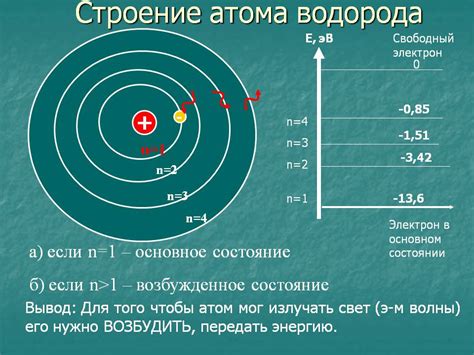
Вначале стоит отметить, что существует модель атома, разработанная Нильсом Бором, которая помогает объяснить, как электроны двигаются вокруг ядра. По этой модели, электроны находятся в определенных энергетических уровнях или "оболочках" вокруг ядра атома. Каждая оболочка имеет определенную энергию.
Когда электрон получает энергию от внешнего источника, например, от поглощения света, он может перейти на более высокий энергетический уровень. Этот процесс называется возбуждением. Однако электрон не может находиться на этом уровне бесконечно долго и, со временем, он возвращается на исходный энергетический уровень, испуская энергию в виде света. Этот процесс называется излучением.
Основные принципы движения электронов вокруг ядра атома
Основными принципами движения электронов являются:
- Принцип квантования энергии: электрон может существовать только на определенных энергетических уровнях, которые называются квантовыми состояниями. Переходы электрона между этими уровнями сопровождаются поглощением или испусканием энергии в виде квантов света - фотонов.
- Принцип неопределенности: согласно этому принципу, невозможно одновременно точно определить положение и скорость электрона. Скорость и положение электрона могут быть измерены только с определенной степенью вероятности.
- Принцип заполнения энергетических уровней: в атоме каждый энергетический уровень может содержать определенное число электронов. Уровни заполняются по принципу возрастания энергии и с учетом правил заполнения орбиталей (например, правило Хунда).
- Принцип периодической закономерности: все атомы имеют сходное строение и химические свойства, которые определяются количеством электронов во внешней оболочке атома. Внешняя оболочка определяет химическую активность элемента.
Соблюдение данных принципов позволяет объяснить спектры атомов, их химические свойства и формирование химических соединений.
Структура атома: ядро и электроны
Электроны, в свою очередь, находятся вокруг ядра и образуют электронную оболочку. Они обладают отрицательным зарядом и массой, значительно меньшей, чем у протонов и нейтронов. Электроны могут находиться на разных энергетических уровнях, которые могут быть представлены в виде оболочек или орбит.
Принципы движения электронов вокруг ядра:
1. Принцип квантования энергии: электроны могут занимать только определенные энергетические уровни, которые являются квантовыми и дискретными. При переходе электрона с одного уровня на другой поглощается или излучается квант энергии в виде фотона.
2. Принцип заполнения оболочек: электроны заполняют энергетические уровни в атоме по стабильным правилам. Наиболее близкие к ядру оболочки могут вмещать меньшее количество электронов, в то время как наиболее дальние оболочки могут вместить большее количество электронов.
Характеристики электронной оболочки:
1. Главные энергетические уровни: электроны располагаются на главных энергетических уровнях, обозначаемых числами n=1,2,3... Чем больше число n, тем выше энергетический уровень.
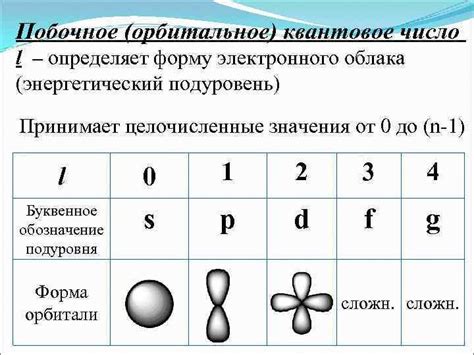
2. Подуровни: каждый главный уровень может содержать несколько подуровней, обозначаемых буквами s, p, d, f. Каждый подуровень имеет свою форму и максимальное количество электронов.
3. Орбитали: орбитали являются пространственными областями, в которых с большей вероятностью находятся электроны. Они также имеют форму и могут быть обозначены буквами s, p, d, f, а также цифрами.
Таким образом, структура атома состоит из ядра, в котором находятся протоны и нейтроны, и электронной оболочки, в которой движутся электроны на разных энергетических уровнях и подуровнях.
Движение электронов по орбитам
По принципу неопределенности Гейзенберга, местоположение электрона на орбите не может быть точно определено. Вместо этого, мы можем говорить о существовании вероятности обнаружения электрона в определенной точке орбиты.
Орбиты электронов имеют разные формы и энергии, которые определяются квантовыми числами электрона. Главное квантовое число, обозначаемое n, описывает энергию электрона и его удаленность от ядра. Чем больше значение n, тем выше энергия электрона и тем дальше он находится от ядра.
Кроме главного квантового числа, орбиты электронов могут также различаться с помощью орбитальных квантовых чисел. Орбитальное квантовое число, обозначаемое l, определяет форму орбиты. Значение l может быть от 0 до n-1 и соответствует форме орбиты: s-орбита (l=0), p-орбита (l=1), d-орбита (l=2) и f-орбита (l=3).
Каждая орбита может содержать разное количество электронов, которое определяется вращательным квантовым числом, обозначаемым m. Вращательное квантовое число может принимать значения от -l до l и определяет ориентацию орбиты в пространстве.
Движение электронов по орбитам является основой атомной структуры и определяет физические и химические свойства атомов. Понимание этого движения позволяет нам лучше понять электронную структуру и взаимодействие между атомами.
Энергетические состояния электронов
Квантование энергии: энергия электрона в атоме может принимать только определенные дискретные значения, называемые энергетическими уровнями или квантовыми состояниями. Между этими уровнями находятся запрещенные зоны, в которых электрон находиться не может.
Принцип заполнения уровней: электроны заполняют энергетические уровни начиная с наименьшей энергии и двигаясь к наибольшей. Наиболее близкий к ядру уровень называется основным, а последующие уровни - возбужденными.
Принцип Паули: каждому энергетическому уровню может находиться максимум два электрона, с противоположными спинами. Это означает, что электроны на одном уровне имеют противоположное направление вращения своих векторов спина.
Распределение электронов: распределение электронов по энергетическим уровням определяет электронную конфигурацию атома. Электроны могут занимать различные орбитали, такие как s, p, d и f, в зависимости от их энергетического уровня и формы орбитали.
Изучение энергетических состояний электронов в атоме позволяет более глубоко понять его химические и физические свойства, а также объяснить формирование химических связей и реакций.
Квантовая механика и движение электронов

Квантовая механика описывает поведение микроскопических частиц, таких как электроны, в атомах. Эта теория позволяет понять, как электроны двигаются вокруг ядра и как образуют все характеристики атома.
Основной принцип квантовой механики, относящийся к движению электрона, называется принципом нерополноты. Согласно этому принципу, в отличие от классической механики, движение электрона не может быть представлено как непрерывная траектория, а имеет волновую природу.
Движение электрона описывается волновой функцией, которая определяет вероятность нахождения электрона в определенном состоянии. Волновая функция содержит информацию о энергии, угловом моменте и других характеристиках электрона.
Согласно принципу неопределенности Гейзенберга, невозможно одновременно точно определить положение и скорость электрона. Это означает, что существует некоторое ограничение на точность, с которой мы можем измерить эти характеристики электрона.
Квантовая механика также объясняет концепцию энергетических уровней и квантования энергии в атоме. Электрон может находиться только на определенных энергетических уровнях, которые определены волновой функцией. Переходы электрона между этими уровнями приводят к поглощению или испусканию фотонов, что объясняет явление поглощения и излучения света атомами.
Таким образом, квантовая механика играет ключевую роль в понимании движения электронов в атомах. Она объясняет не только распределение электронов в энергетических оболочках, но и формирование химических связей, спектральные линии и многие другие характеристики атомов и молекул.
Орбитали и их характеристики
Существует несколько типов орбиталей, которые различаются по своей форме и ориентации. Например, s-орбитали имеют сферическую форму и круговую симметрию относительно ядра. Они могут содержать максимум два электрона с противоположной спиновой ориентацией.
P-орбитали представляют собой две лобковые формы и одну платообразную форму. Они расположены поодиночности в трех различных плоскостях, перпендикулярных друг к другу. Каждая p-орбиталь может содержать максимум 6 электронов.
D-орбитали имеют сложную форму и ориентацию, которая определяется четырьмя дополнительными квантовыми числами. Они разделены на пять различных подобластей - dxy, dyz, dxz, dz2 и dx2-y2. Всего d-орбитали могут содержать максимум 10 электронов.
Ф-орбитали имеют самую сложную структуру и ориентацию из всех типов орбиталей. Они также имеют семь различных подобластей, которые образуется комбинацией d- и p-орбиталей. Всего f-орбитали могут содержать максимум 14 электронов.
Орбитали играют важную роль в определении электронной структуры атомов и молекул. Количество и типы орбиталей в атоме определяют его энергетический спектр и химические свойства. Более точное понимание орбиталей и их характеристик позволяет увидеть, как электроны распределены в атоме и как они участвуют в химических реакциях.
Теория валентной связи и электронные оболочки

Внутренние оболочки, ближе к ядру атома, заполняются электронами в первую очередь. Они имеют наименьшую энергию и наиболее стабильны. Внешняя оболочка, также называемая валентной оболочкой, содержит электроны с наибольшей энергией и она имеет наибольшую роль в химических реакциях.
Электроны на валентной оболочке могут образовывать связи с другими атомами или подвергаться обмену. Это происходит при образовании простого и множественного связей, при образовании ионных связей, а также при образовании кондуктивных связей. Вся химическая активность атома определяется состоянием его валентной оболочки.
С учетом этих характеристик возможно предсказать способность атома образовывать химическую связь, его агрессивность и степень вовлеченности в химические реакции. Теория валентной связи и понимание электронных оболочек являются основой для объяснения свойств и поведения атомов и молекул в химии.
Распределение электронов по энергетическим уровням
Первый энергетический уровень находится ближе всего к ядру и имеет наименьшую энергию. Следующие уровни располагаются на большем удалении от ядра и имеют все бóльшую энергию. Количество энергетических уровней определяется атомным номером элемента и показывает, сколько энергетических уровней доступно для распределения электронов.
Каждый энергетический уровень может вместить определенное количество электронов. Первый уровень, ближайший к ядру, может вместить максимум 2 электрона. Второй уровень может вместить 8 электронов, а третий уровень - до 18 электронов. Это правило известно как правило Клейтоника-Паули, и оно определяет порядок заполнения энергетических уровней электронами.
Распределение электронов по энергетическим уровням описывается электронной конфигурацией, которая представляет собой последовательность чисел и букв, указывающих количество электронов на каждом энергетическом уровне и их магнитный спин. Например, электронная конфигурация для атома кислорода (O) равна 1s2 2s2 2p4, что означает, что на первом энергетическом уровне находятся 2 электрона, на втором уровне - 2 электрона, а на третьем уровне - 4 электрона.
Распределение электронов по энергетическим уровням имеет большое значение, так как определяет свойства и химические реакции атома. Признание и понимание этого распределения является ключевым элементом для понимания строения и свойств всех элементов в периодической системе.




