Бромирование - одна из важнейших реакций органической химии, при которой атомы водорода в молекуле органического соединения замещаются атомами брома. Однако, не все соединения одинаково легко поддаются этой реакции. Рассмотрим, как проходит бромирование в случае бензойной кислоты и бензола, и какие факторы влияют на скорость этой реакции.
Бензойная кислота - органическое соединение, представляющее собой бензольное кольцо, в котором атом кислорода замещен атомом водорода. Молекула бензойной кислоты содержит главную функциональную группу - карбоксильную (COOH). Из-за наличия этой группы, молекула бензойной кислоты обладает высокой реакционной способностью и готова подвергнуться бромированию. Однако, на скорость реакции бромирования может оказывать влияние не только функциональная группа, но и другие факторы.
Бензол - ароматическое соединение, образующее кольцевую структуру, состоящую из шести атомов углерода. Молекула бензола не содержит функциональных групп и, следовательно, несколько слабее реакционноспособна, чем бензойная кислота. Тем не менее, это не означает, что бензол не может подвергнуться бромированию. Это делает его уникальным объектом для изучения различных условий реакции и факторов, влияющих на скорость бромирования.
Бензойная кислота и бензол: различие в реакционной способности
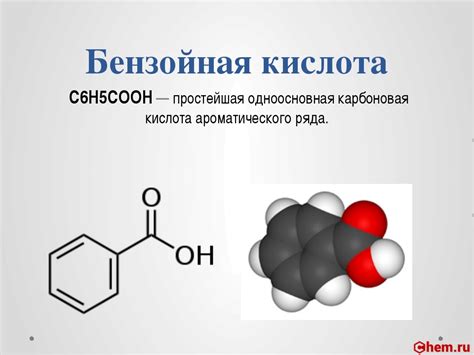
Бензойная кислота имеет карбоксильную группу (-COOH), делающую ее кислотой. Карбоксильная группа придает кислоту реакционную способность, а именно, она может активировать молекулу кислоты для многих химических превращений.
Одной из реакций, в которых бензойная кислота проявляет свою способность, является бромирование. В результате этой реакции бензойная кислота может замещать один или несколько атомов водорода в молекуле под действием брома.
С другой стороны, бензол, не имея функциональных групп, не обладает реакционной способностью бензойной кислоты. Это связано с отсутствием активных групп, которые могли бы участвовать в химических превращениях.
Таким образом, бензойная кислота, благодаря карбоксильной группе, обладает гораздо большей реакционной способностью по сравнению с бензолом, который не имеет функциональных групп в своей структуре. Это различие в реакционной способности является значительным и определяет разнообразие химических превращений, которые могут происходить с данными соединениями.
Бромирование бензойной кислоты: факторы, влияющие на скорость реакции
Бромирование бензойной кислоты – это химическая реакция, в результате которой на молекуле кислоты замещаются один или несколько атомов водорода атомами брома. Данная реакция происходит в присутствии брома (Br2) и катализатора, часто используется уксусная кислота (CH3COOH) или ацетон (CH3СOCH3).
Скорость реакции бромирования бензойной кислоты зависит от нескольких факторов:
- Концентрация реагентов: чем выше концентрация бензойной кислоты, брома и катализатора, тем быстрее протекает реакция.
- Температура: повышение температуры обычно увеличивает скорость реакции, поскольку это способствует более интенсивному столкновению молекул.
- Растворитель: используемый растворитель также может влиять на скорость реакции. Например, ацетон способствует лучшему смешиванию реагентов и ускоряет бромирование бензойной кислоты.
- Размер частиц: если реакция происходит в газовой фазе или в растворе, размер частиц реагентов влияет на скорость реакции. Мелкие частицы имеют большую поверхность контакта и более интенсивно взаимодействуют, что способствует ускорению реакции.
Таким образом, бромирование бензойной кислоты – это сложная реакция, результаты которой зависят от нескольких факторов. Правильный выбор условий реакции может увеличить скорость реакции и получить желаемый продукт.
Бромирование бензола: особенности и причины медленной реакции
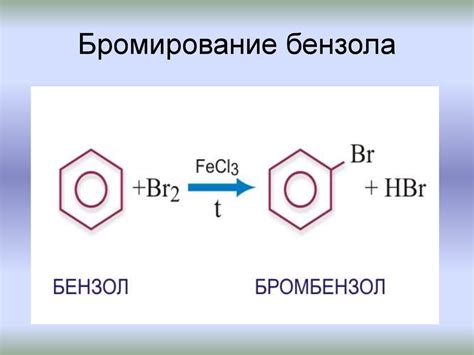
Особенностью бромирования бензола является его медленная реакция по сравнению с бромированием алканов или алкенов. Это объясняется электронной структурой бензола и его ароматичностью. Бензол содержит шесть p-электронов в своих пи-молекулярных орбиталях. Эти электроны образуют сеть непрерывных p-связей, что делает молекулу бензола электронно стабильной.
Механизм бромирования бензола сложнее, чем бромирование алканов или алкенов, и включает образование электрофильного комплекса. Кроме того, бензол обладает высокой степенью ароматичности, что делает его менее реакционноспособным по сравнению с другими органическими соединениями.
Таблица ниже сравнивает скорость бромирования бензола и бензойной кислоты:
| Вещество | Скорость реакции бромирования |
|---|---|
| Бензол | Медленная |
| Бензойная кислота | Более быстрая |
Различие в скорости реакций бромирования бензола и бензойной кислоты обусловлено различием в ароматической структуре и электронной плотности в молекулах данных соединений. Бензол, благодаря своей ароматичности, обладает большей электронной стабильностью, что затрудняет атаку электрофильного агента, такого как бром. В случае бензойной кислоты, наличие карбоксильной группы делает молекулу более реакционноспособной и способствует более быстрой реакции с бромом.
Реакционная способность бензойной кислоты: факторы, выступающие в качестве хорошего электрофила
Карбоксильная группа представляет собой функциональную группу, содержащую электронное дефицитное атомное ядро, способное либо принимать электроны, либо реагировать с электрофилами. Такое ядро может привлекать и отталкивать электроны, взаимодействуя с другими молекулами.
Список факторов, которые придают бензойной кислоте хорошие электрофильные свойства:
- Карбоксильная группа -COOH: этот функциональный фрагмент является главным электрофильным центром бензойной кислоты. Она привлекает электроны и активно реагирует с нуклеофилами, такими как бром или другие электрофилы.
- Электронная плотность: наличие ароматического ядра в бензойной кислоте образует плотное "облако" электронов, которое удерживается введенной в его структуру карбоксильной группой. Этот электронный избыток на ароматическом кольце делает бензойную кислоту более нуклеофильной и способной взаимодействовать с электрофилами.
- Резонансная стабилизация: бензойная кислота обладает резонансной стабилизацией, которая способствует усилению ее электрофильности. Резонансное распределение электронов в ароматическом кольце делает бензойную кислоту более электрофильной по сравнению с бензолом.
Вышеперечисленные факторы совместно делают бензойную кислоту привлекательным электрофилом, способным претерпевать реакции бромирования и другие электрофильные атаки. Это обусловливает более высокую реакционную способность бензойной кислоты по сравнению с бензолом.
Реакционная способность бензола: причины низкой реакционной активности
Если сравнить реакционную способность бензола с бензойной кислотой, то можно заметить, что бензойная кислота более легко подвергается бромированию. Это связано с различием в их функциональных группах и строении.
Первая причина низкой реакционной активности бензола – это сохранение ароматических свойств кольца. В ароматическом кольце электроны расположены по системе пи-электронных облаков, что обеспечивает его стабильность. Бензол обладает делиоканической структурой, где пи-электроны образуют систему, благодаря которой кольцо имеет делиоканический характер.
Вторая причина заключается в положении электрофильной атаки. В бензоле электрофильные агенты атакуют нашей ароатические кольцо, и это приводит к непоправимому нарушению ароматичности этого кольца. Поэтому молекулы бензола не проявляют реактивности в отношении агентов делиоканического атаНокаТарваИнеИщ-ТаРо ЦЬ ГтЦ ТЦ АГаНуНин, но гтаМню реагировать с электрофильными агентами.
Третья причина заключается в слабой поляризации связей углерод-углерод в ароматическом кольце. Атомы углерода в бензоле образуют п-связи, которые обладают высокой степенью симметрии, и поэтому их поляризация становится невозможной. Из-за слабой поляризации атомов углерода затруднено образование новых связей между электрофильными агентами.
Сочетание этих трех факторов – сохранение ароматичности кольца, положение электрофильной атаки и слабая поляризация связей углерод-углерод – приводит к тому, что бензол обладает низкой реакционной активностью.




