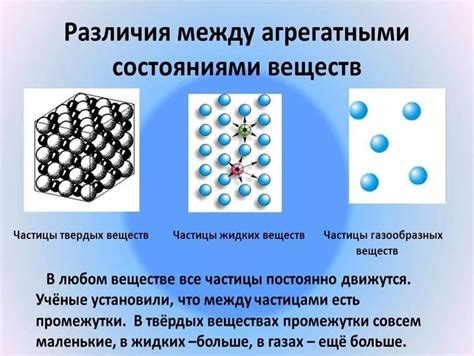
Вещества молекулярного и немолекулярного строения являются основными типами химических соединений, которые различаются по структуре и свойствам. Молекулярное строение характеризуется наличием молекул, состоящих из двух или более атомов, которые связаны между собой химическими связями.
Однако, немолекулярные вещества не образуют молекулы и состоят из атомов одного элемента или ионов. Они могут быть представлены элементами, такими как кислород, азот или хлор, или ионами, такими как натрий, кальций или калий. Структура немолекулярных веществ может быть простой или состоять из массивных кристаллических структур.
Главное различие между веществами молекулярного и немолекулярного строения заключается в способе, как атомы связаны между собой. В молекулярных веществах атомы образуют молекулы, где эти атомы могут быть связаны одной или несколькими химическими связями. В немолекулярных веществах атомы могут быть связаны ионными связями, координационными связями или металлическими связями.
Молекулярное строение вещества
Молекулярное строение вещества представляет собой взаимное расположение атомов, которые связаны друг с другом через химические связи. Молекулы могут быть различных размеров и форм, в зависимости от количества атомов в них.
Молекулярное строение определяет как физические, так и химические свойства вещества. Например, размер и форма молекул влияют на точку плавления и кипения вещества, его плотность, растворимость и т.д.
Все молекулы состоят из атомов, которые могут быть одного или разных элементов. Атомы связываются друг с другом через сильные химические связи, такие как ковалентные связи. Ковалентные связи образуются, когда электроны, находящиеся во внешних оболочках атомов, разделяются между атомами.
Разные вещества имеют различное молекулярное строение. Например, вода (H2O) имеет одну кислородную и две водородные атомы, связанные ковалентными связями. В молекуле углекислого газа (CO2) два атома кислорода связаны с одним атомом углерода. Однако молекулы веществ могут быть более сложными и содержать большее количество атомов.
Молекулярное строение вещества может быть представлено с помощью структурных формул или моделей, которые показывают связи между атомами и их взаимное расположение. Эти модели могут быть двумерными или трехмерными и помогают визуализировать строение вещества.
Молекулярное строение вещества также влияет на его химическую реактивность и способность образовывать новые вещества при контакте с другими веществами. Молекулы с определенным строением могут образовывать сложные химические соединения и проявлять различные свойства в зависимости от своей структуры.
Немолекулярное строение вещества
Основным примером немолекулярного строения являются металлы, которые состоят из кристаллической решетки атомов. Эти атомы связаны слабыми силами Ван-дер-Ваальса, и поэтому металлы обладают высокой пластичностью и проводимостью тепла и электричества.
Также к немолекулярным веществам относятся ионные кристаллы, такие как соль или кварц. В ионных кристаллах положительные ионы и отрицательные ионы образуют кристаллическую решетку и притягиваются друг к другу с помощью сильных электростатических сил. Это объясняет высокие температуры плавления и варки ионных кристаллов.
Немолекулярные вещества обладают рядом характерных свойств, таких как высокая твердость, хрупкость или электрическая проводимость. Они также имеют высокую температуру плавления и варки, что связано с наличием сильных притяжений между элементарными частицами.
Примеры немолекулярных веществ:
- Металлы (железо, алюминий, медь).
- Ионные кристаллы (хлорид натрия, оксид кальция).
- Жидкие металлы (ртуть, галлий).
- Скелетные и каркасные соединения (алюмосиликаты, карбоны).
- Модифицированные полимерные материалы (стекло, керамика).
Немолекулярное строение вещества имеет фундаментальное значение для понимания его свойств и применений в различных областях науки и техники.
Как образуются молекулы

Молекулы образуются в результате химических реакций между атомами. Атомы могут соединяться между собой путем обмена или общего использования своих электронов. Они могут также образовывать ковалентные, ионные или металлические связи.
Ковалентная связь возникает, когда два или более атома делают общий вклад в свои электроны, чтобы образовать общую пару электронов. Это тип связи, который связывает атомы в молекулярные соединения.
Ионная связь возникает между атомами, когда один атом отдаёт электрон(ы), а другой атом принимает электрон(ы). Полученные или потерянные электроны превращают атомы в ионы, которые притягиваются друг к другу благодаря противоположным зарядам.
Металлическая связь образуется в металлах, где электроны между атомами свободно перемещаются. Это делает металлы хорошими проводниками электричества и тепла.
Образование молекул может происходить при различных условиях, включая добавление энергии (как в случае с электрическими разрядами или высокой температурой), а также с использованием катализаторов, которые ускоряют химические реакции.
| Тип связи | Примеры |
|---|---|
| Ковалентная связь | Образование молекулы воды (H2O) |
| Ионная связь | Образование молекулы хлорида натрия (NaCl) |
| Металлическая связь | Образование молекулы золота (Au) |
Способ образования молекул определяет их свойства и характеристики, такие как точка плавления, температура кипения, электропроводность и т. д. Молекулярное строение веществ играет важную роль в определении их физических и химических свойств.
Типичные представители веществ с молекулярным строением
- Кислород (О2) - безцветный газ, который имеет свойство поддерживать горение и необходим для дыхания живых организмов.
- Ацетон (С3Н6О) - прозрачная жидкость, которая используется в бытовых и промышленных целях, например, в качестве растворителя или раствора для снятия лака с ногтей.
- Этилен (С2Н4) - газ, который используется в промышленности для производства пластмасс и резины.
- Бензол (С6Н6) - прозрачная жидкость, которая используется в химической промышленности, включая производство пластмасс, красителей и лекарственных препаратов.
Все эти вещества обладают своими уникальными свойствами, которые определяются их молекулярной структурой. Это только некоторые примеры представителей веществ с молекулярным строением, их существует значительно больше.
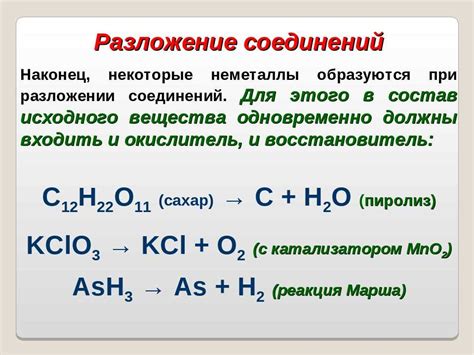
Типичные представители веществ с немолекулярным строением:
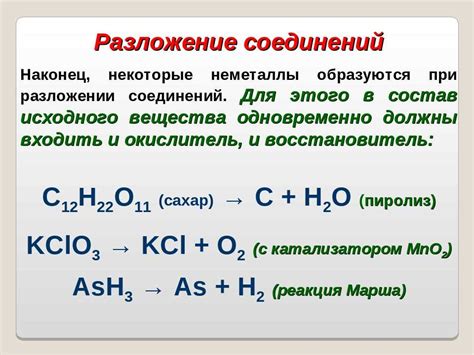
- Элементарные вещества - это вещества, состоящие из атомов одного вида. Представители: кислород, водород, углерод, азот и другие химические элементы;
- Ионные соединения - это вещества, состоящие из положительных и отрицательных ионов. Представители: соли (например, натрий хлорид - NaCl), галогениды (например, медный хлорид - CuCl2) и другие;
- Металлы - это вещества, обладающие металлическим свойством, то есть хорошей электропроводностью и гибкостью. Представители: железо, алюминий, медь, золото и другие металлы;
- Сетчатые соединения - это вещества, состоящие из атомов, объединенных в трехмерные сетки. Представители: алмаз, графит, кварц и другие минералы;
- Аморфные вещества - это вещества без определенной кристаллической структуры. Представители: стекло, пластик, резина и другие аморфные материалы.
Уникальные свойства вещества с молекулярным строением
В молекулярных веществах могут существовать разнообразные типы химических связей, такие как ковалентная, ионная, водородная и дисперсионная. Благодаря такому разнообразию химических связей молекулы вещества могут образовывать многообразные структуры, включая цепочки, кольца, слои и трехмерные сетки.
Эти структуры придают веществам с молекулярным строением такие уникальные свойства, как плотность, прочность, тугоплавкость и эластичность. Например, высокомолекулярные соединения, такие как поликарбонат или полиамиды, обладают высокой прочностью и устойчивостью к механическим нагрузкам.
Еще одним важным свойством веществ с молекулярным строением является возможность формирования взаимодействий между молекулами. Межмолекулярные силы притяжения, такие как дисперсионные силы Ван-дер-Ваальса, диполь-дипольные взаимодействия и водородные связи, играют существенную роль в определении свойств вещества.
Некоторые вещества с молекулярным строением обладают специфическими свойствами, такими как ферромагнетизм или фотолюминесценция. В таких случаях молекулярные структуры вещества оказывают существенное влияние на его оптические, магнитные и электронные свойства.
Таким образом, вещества с молекулярным строением обладают множеством уникальных свойств, которые определяются их структурой и взаимодействиями между молекулами. Эти свойства являются основой для широкого спектра приложений таких веществ в различных областях науки, техники и медицины.
Уникальные свойства вещества с немолекулярным строением
Вещества с немолекулярным строением представляют собой соединения, состоящие из атомов одного или нескольких элементов, которые не образуют молекулы, а существуют в форме ионов, атомов или кристаллической решетки. У таких веществ отсутствует молекулярная структура, что придает им уникальные свойства и поведение.
Одним из главных уникальных свойств веществ с немолекулярным строением является их высокая температура плавления и кипения. Это связано с силами взаимодействия между атомами или ионами, которые являются значительно более сильными, чем межмолекулярные силы в веществах с молекулярным строением. Благодаря этому вещества с немолекулярным строением обладают высокой стойкостью к температурным воздействиям.
К немолекулярным веществам относятся, например, железо, алюминий, кремний, а также большинство солей и ионных соединений.
Еще одним уникальным свойством вещества с немолекулярным строением является его электропроводность. В отличие от молекулярных веществ, в которых электропроводность возникает только при наличии свободных электронов или ионов, немолекулярные вещества могут проводить электрический ток благодаря движению связанных электронов внутри своей кристаллической решетки или из-за того, что они содержат ионы, способные передавать электроны.
Также следует отметить, что вещества с немолекулярным строением обладают высокой твердостью и прочностью. Это связано с их кристаллической структурой, в которой атомы или ионы тесно связаны между собой. Благодаря этому они обладают высокой устойчивостью к механическим нагрузкам и абразивному износу. Например, алмаз, который является немолекулярным веществом, является самым твердым известным материалом на Земле.
Применение веществ с молекулярным и немолекулярным строением
Вещества с молекулярным и немолекулярным строением находят широкое применение в различных областях науки и техники.
Молекулярные вещества используются в химической промышленности, фармацевтике, косметической и пищевой промышленности. Они являются основой для создания множества препаратов, косметических средств и пищевых добавок. Молекулярные вещества также широко применяются в лабораторных исследованиях, для получения покрытий и пленок, а также в процессах синтеза новых материалов.
Немолекулярные вещества (или ионные соединения) активно используются в электротехнике, электролитических процессах и батареях. Немолекулярные вещества также применяются в производстве стекла, керамики, порошковых материалов, а также в различных процессах очистки и обработки воды.
Каждый тип вещества имеет свои особенности и уникальные свойства, которые определяют их способность к применению в определенных сферах. Правильный выбор вещества и его структуры играет ключевую роль в успешной реализации различных технологий и процессов.




