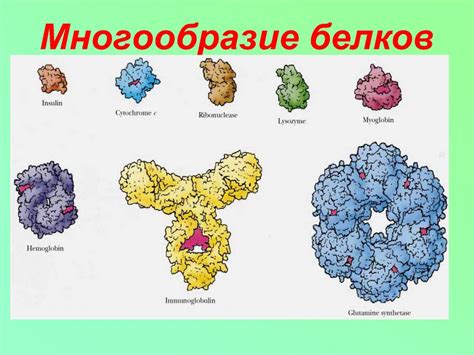
Белки - это одна из основных групп органических молекул, состоящих из аминокислотных остатков, связанных между собой пептидными связями. Они играют важную роль в клеточных процессах и выполняют различные функции в организме. Многообразие белков можно объяснить их уникальной структурой и последующими функциональными возможностями.
Структура белков определяется последовательностью аминокислот, которая закодирована в генетической информации. Каждая аминокислота имеет свою специфическую структуру, а их различное сочетание позволяет создать огромное разнообразие белков. Существует 20 стандартных аминокислот, и их последовательность в белке определяется генетической информацией, записанной в ДНК.
Кроме того, структура белков может быть различной из-за взаимодействия аминокислотных остатков между собой. Белки могут образовывать сложные трехмерные структуры, такие как спиралевидные альфа-витки и свернутые листовые структуры бета-складок. Эти трехмерные структуры определяют форму и функцию белков, и их разнообразие может быть огромным.
Структурное и функциональное многообразие белков: что определяет?
В основе структурного и функционального многообразия белков лежит генетическая информация, содержащаяся в ДНК. Каждый белок обладает определенной последовательностью аминокислот, которая закодирована в гене. Изменения в генетической последовательности могут привести к появлению новых белков или изменению структуры и функций уже существующих.
Структура белков определяется их аминокислотной последовательностью и несколькими факторами. В первую очередь, это связано с силами взаимодействия между аминокислотами, а также физическими и химическими свойствами окружающей среды. Белки имеют сложную трехмерную структуру, которая определяет их способность взаимодействовать с другими молекулами и выполнять свои функции.
Функциональное многообразие белков обусловлено их структурой и способностью взаимодействовать с другими молекулами. Белки могут выполнять разнообразные функции в организме, такие как катализ химических реакций, транспорт молекул, защита от инфекций и регуляция генов. Каждая функция требует определенной структуры и специфического взаимодействия с молекулами-мишенями.
Итак, многообразие белков определяется генетической информацией, взаимодействием аминокислот и окружающей среды, а также их способностью взаимодействовать с другими молекулами. Эти факторы делают белки не только основными строительными блоками живых организмов, но и ключевыми игроками в поддержании жизненных процессов.
Роль генетического кода
Генетический код представляет собой набор трехнуклеотидных последовательностей, называемых кодонами. Каждый кодон осуществляет трансляцию генетической информации, закодированной в ДНК, на синтез определенной аминокислоты. Таким образом, генетический код тесно связан с протеиновым синтезом и определяет порядок, в котором аминокислоты собираются в полипептидные цепи.
Благодаря генетическому коду, разнообразие возможных комбинаций аминокислот в белке огромно. Это позволяет белкам выполнять различные функции в клетке, такие как каталитическая активность, структурная поддержка, передача сигналов и многое другое.
Также генетический код обеспечивает универсальность белкового синтеза во всех живых организмах. Вне зависимости от вида, все они используют одинаковый набор кодонов для трансляции генетической информации. Это означает, что генетический код является универсальным языком, позволяющим коммуникацию между различными видами живых организмов.
Таким образом, генетический код играет ключевую роль в определении структурного и функционального многообразия белков. Он является основным строительным материалом для синтеза белков и обеспечивает их разнообразие и функциональную специфичность.
Влияние аминокислотной последовательности
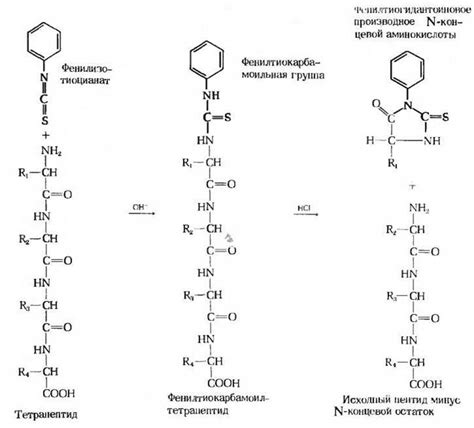
Структурное и функциональное многообразие белков определяется их аминокислотной последовательностью.
Каждая белковая молекула состоит из линейной цепочки аминокислот, которые образуются путем последовательного соединения. Замещение, удаление или добавление аминокислот в этой цепочке может привести к изменению структуры и функции белка.
Замещение аминокислоты может изменить взаимодействие белка с другими молекулами, такими как ферменты или гормоны. Например, замена гидрофильной аминокислоты на гидрофобную может изменить гидрофильность поверхности белка, что в свою очередь повлияет на его способность взаимодействовать с водой и другими молекулами.
Удаление или добавление аминокислот может привести к изменению структуры белка и его функции. Например, удаление аминокислот может привести к образованию гаплотипов и изменению активности ферментов. Добавление аминокислот может привести к изменению длины цепочки и структуре белка, что может изменить его взаимодействие с другими молекулами и активностью.
Таким образом, аминокислотная последовательность играет решающую роль в структуре и функции белков. Внесение даже небольших изменений в эту последовательность может привести к значительным изменениям в свойствах белка, что отражается на его функционировании в живых организмах.
Взаимодействие белков с другими молекулами
Белки играют важную роль во многих биологических процессах и взаимодействуют с другими молекулами, такими как ДНК, РНК, липиды и другие белки. Взаимодействие белков с другими молекулами определяет их структурное и функциональное многообразие.
Одним из типов взаимодействия белков с другими молекулами является связывание с ДНК. Белки, называемые транскрипционными факторами, связываются с определенными участками ДНК и регулируют процессы транскрипции и трансляции. Это позволяет управлять активностью генов и синтезировать нужные белки.
Важным видом взаимодействия белков является связывание с РНК. Белки, называемые рибозомными белками, связываются с рибосомами и обеспечивают процессы белкового синтеза. Они помогают прочитывать информацию, содержащуюся в молекулах РНК, и обеспечивают правильную сборку аминокислот в цепь белка.
Белки также могут взаимодействовать с липидами, основными компонентами клеточных мембран. Они способны связываться с липидами и изменять структуру мембран, что влияет на их проницаемость и способность передавать сигналы.
Помимо этого, белки могут взаимодействовать с другими белками. Такие белковые комплексы играют важную роль во многих биологических процессах, таких как передача сигналов внутри клетки, клеточная адгезия, сборка структурных компонентов и т. д.
Взаимодействие белков с другими молекулами является сложным и точно регулируемым процессом. Это взаимодействие определяется структурой белков и их функциональными доменами. Комбинируя различные домены и изменяя их структуру, белки могут формировать различные связи с другими молекулами и выполнять разнообразные функции в клетке.
Формирование третичной и кватернической структуры
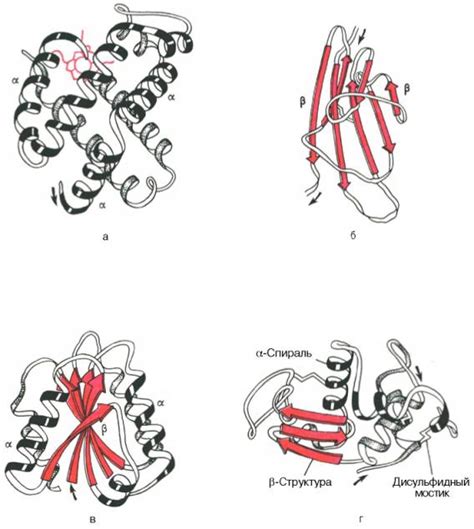
После образования вторичной структуры, цепочка аминокислот продолжает складываться, образуя третичную структуру белка. Формирование третичной структуры определяется силами притяжения и отталкивания между различными атомами внутри белка.
Основными силами, которые стабилизируют третичную структуру, являются гидрофобные взаимодействия, электростатические взаимодействия и водородные связи. Гидрофобные взаимодействия происходят между гидрофобными аминокислотами, которые стремятся избегать контакта с водой. Электростатические взаимодействия возникают между заряженными аминокислотами, такими как аминокислоты с положительным и отрицательным зарядом. Водородные связи образуются между атомами водорода и атомами кислорода или азота.
Кватерническая структура белка образуется путем взаимодействия нескольких цепочек аминокислот, образуя сложные трехмерные структуры. Эти взаимодействия также могут включать гидрофобные взаимодействия, электростатические взаимодействия и водородные связи. Кватерническая структура играет важную роль в функционировании белка и определяет его специфичность и активность.
| Структура | Описание |
|---|---|
| Третичная | Трехмерная структура белка, образованная взаимодействиями между атомами внутри белковой цепи. |
| Кватерническая | Сложная трехмерная структура, образованная взаимодействиями между несколькими цепочками аминокислот. |
Влияние окружающей среды на структуру и функцию белков
Одним из факторов окружающей среды, оказывающих влияние на структуру белков, является pH. Изменение pH может привести к денатурации белков, то есть разрушению их третичной и кватернической структуры. Например, при увеличении pH происходит дезаминирование аминокислот, что может привести к нарушению связей внутри белковой цепочки. Также изменение pH может повлиять на заряды аминокислотных остатков, что может изменить способность белков взаимодействовать с другими молекулами.
Другим фактором окружающей среды, влияющим на структуру белков, является температура. Высокие температуры могут вызывать денатурацию белков, так как они способствуют разрыву слабых внутримолекулярных взаимодействий, ответственных за устойчивость третичной структуры белка. Низкие температуры также могут влиять на структуру белков, вызывая их конформационные изменения и приводя к образованию агрегатов.
Окружающая среда также может влиять на функцию белков. Например, наличие определенных ионов в окружающей среде может активировать или ингибировать функцию белков. Различные металлы, такие как кальций или железо, могут играть роль кофакторов и быть необходимыми для активности определенных ферментов. Кроме того, наличие других молекул, таких как липиды или нуклеотиды, может изменять способность белков взаимодействовать с ними и выполнять свою функцию.
Таким образом, окружающая среда играет важную роль в формировании структуры и функции белков. Изменение pH, температуры или наличие определенных молекул в окружающей среде может привести к изменению конформации и активности белков, что влияет на их функциональное многообразие.
Механизмы регуляции активности белков
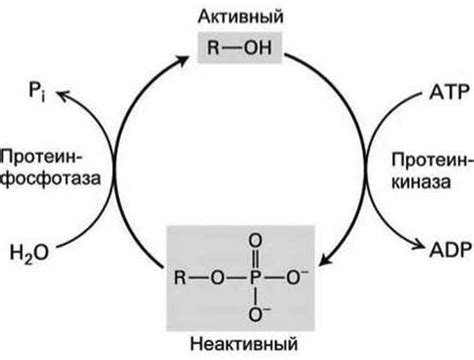
Посттрансляционные модификации, такие как фосфорилирование, активация или ингибирование, метилирование и ацетилирование, позволяют изменять конформацию белка и, следовательно, его активность. Например, фосфорилирование белков может приводить к изменению их структуры и активации или ингибированию функциональной активности.
Кроме того, активность белков может регулироваться уровнем их экспрессии. Экспрессия белков может быть контролируема на уровне транскрипции, при котором ДНК транскрибируется в молекулы РНК, и на уровне трансляции, при котором РНК транслируется в белки. Регуляция экспрессии белков осуществляется с помощью различных факторов, включая промоторные и репрессорные белки, микроРНК и эпигенетические механизмы.
Другим важным механизмом регуляции активности белков является их взаимодействие с другими белками. Многие белки вступают в сложные взаимодействия с другими компонентами клетки, образуя белковые комплексы и сети. Такие взаимодействия могут изменять активность белка, регулировать его местоположение в клетке или влиять на его стабильность.
В целом, механизмы регуляции активности белков обеспечивают организмам возможность адаптироваться к изменяющимся условиям и обеспечивать оптимальное функционирование клеток и органов.
Эволюционное развитие белков
Белки представляют огромное разнообразие структур и функций. Изначально, все белки происходят из одной примитивной молекулы, но в процессе эволюции они претерпевали изменения и развились во множество различных форм.
Эволюция белков происходит посредством генетических мутаций и дубликаций генов. Мутации изменяют последовательность аминокислот в белковой цепи, что может приводить к изменениям в их структуре и функции. Дубликации генов, в свою очередь, дают возможность для дальнейшей эволюции белков.
В результате эволюции, возникают новые виды белков с различными структурами и функциями. Некоторые белки приобретают новые функции, позволяющие им выполнять новые задачи в клетках и организмах. Другие белки могут потерять свою исходную функцию или стать узкоспециализированными.
Эволюционное развитие белков играет важную роль в приспособлении организмов к изменяющимся условиям окружающей среды. Благодаря разнообразию белков, организмы могут адаптироваться к новым условиям, вырабатывая специфические молекулы для выполнения конкретных функций.
Таким образом, эволюционное развитие белков является важным фактором, определяющим структурное и функциональное многообразие этих молекул. Оно позволяет организмам развиваться и адаптироваться к переменам в окружающей среде, обеспечивая свою выживаемость и разнообразие живых организмов на Земле.




