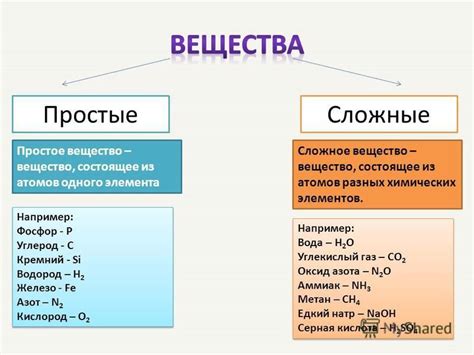
BaCl2 представляет собой химическое соединение, состоящее из ионов бария (Ba2+) и хлора (Cl-). Это бесцветные кристаллы, растворимые в воде. BaCl2 часто используется в химической промышленности, лабораториях и других областях.
Одним из основных свойств BaCl2 является его способность образовывать растворы, в которых главную роль играют ионы бария и хлорида. BaCl2 обладает высокой растворимостью в воде и легко диссоциирует на ионы, что делает его полезным в различных химических реакциях и процессах.
Кроме того, BaCl2 обладает другими интересными свойствами. Например, его растворы являются бледно-зелеными и обладают характерным запахом. Благодаря этим особенностям BaCl2 легко определять в лабораторных условиях и использовать для различных целей. Он может использоваться в химии для исследования ионных реакций, проведения химических экспериментов и производства других соединений.
Вещество BaCl2 в химии и его свойства
Благодаря своим уникальным свойствам, BaCl2 играет важную роль в химической индустрии и научных исследованиях.
BaCl2 или хлорид бария - бесцветные кристаллы, обладающие гигроскопичностью. Они хорошо растворяются в воде, образуя безцветный раствор. Низкая токсичность и хорошая растворимость делают его популярным в применении в различных областях химии.
BaCl2 широко используется в лабораторных исследованиях и синтезе химических соединений. Он служит источником бария и хлорида, которые используются во многих химических реакциях.
Одним из основных свойств BaCl2 является его способность формировать комплексные соединения с различными анионами и молекулами. Это делает его ценным компонентом в химической аналитике и качестве промышленного катализатора.
Также BaCl2 используется в процессе обработки текстильных материалов, противопожарной защите и как селективный пигмент в производстве красок и керамики. Благодаря своим свойствам, BaCl2 находит широкое применение в различных отраслях промышленности.
Однако следует помнить, что BaCl2 является веществом, которое следует обращаться с осторожностью. Оно является раздражающим веществом, поэтому при работе с ним необходимо соблюдать все меры предосторожности и носить соответствующую защитную экипировку.
Описание BaCl2: состав и структура вещества
Благородное вещество BaCl2, также известное как Барий хлорид, состоит из атомов бария (Ba) и атомов хлора (Cl). Формула этого химического соединения указывает на то, что в нем присутствуют два атома хлора для каждого атома бария.
Барий хлорид представляет собой белые кристаллические или порошкообразные соединения. Он обладает высокой растворимостью в воде и находится в состоянии гидратации, то есть молекулы воды связываются с молекулами BaCl2. Гидратированные формы BaCl2 имеют обозначение BaCl2·nH2O, где n - количество молекул воды, связанных с одной молекулой бария хлорида.
Структурно BaCl2 представляет собой ионный кристалл, в котором положительные ионы бария (Ba2+) образуют кристаллическую решетку, а отрицательные ионы хлора (Cl-) находятся в промежутках этой решетки. Такая структура делает BaCl2 полярным соединением.
Барий хлорид является источником бария и хлора при многих процессах, включая производство других химических соединений и проведение лабораторных экспериментов. Он также используется в медицине и стоматологии.
Физические свойства Bacl2: плотность, температура плавления и кипения
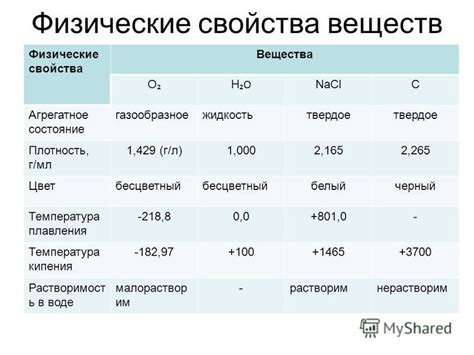
Плотность:
Бромист бария (BaCl2) в чистом виде является кристаллическим веществом. Его плотность составляет около 3,85 г/см3. Химическая формула бромида бария описывает соотношение атомов вещества.
Температура плавления:
Температура плавления для бромида бария составляет около 856°C. Это означает, что при нагревании до этой температуры бромид бария переходит из твердого состояния в жидкое.
Температура кипения:
Бромид бария не обладает точкой кипения, так как он разлагается до бария и брома при нагревании до высоких температур.
Химические свойства BaCl2: реакция с водой и кислотами
Когда BaCl2 взаимодействует с водой, происходит реакция гидратации, в результате которой образуется гидратированный бариев хлорид. Вода вступает в реакцию с ионами бария и хлорида, образуя гидратированный комплекс.
Бариев хлорид также реагирует с некоторыми кислотами, например с соляной кислотой (HCl). В результате реакции образуются соответствующие соли и вода. Например, реакция бариев хлорида с соляной кислотой приводит к образованию бариевого хлорида и воды:
BaCl2 + 2HCl → BaCl2 + 2H2O
Эта реакция является классическим примером реакции образования соли.
Таким образом, BaCl2 проявляет химические свойства при взаимодействии с водой и кислотами. Это вещество может использоваться в различных химических процессах и применениях.
Применение BaCl2 в промышленности и научных исследованиях
Применение BaCl2 в производстве стекла
- Барий хлорид используется в производстве оптического стекла для улучшения прозрачности и устойчивости к ультрафиолетовому излучению.
- Он также добавляется в стекло для уменьшения его показателя преломления и создания оптических линз.
Применение BaCl2 в химической промышленности
- Барий хлорид используется в производстве бария и его соединений, которые находят применение в производстве красителей, пигментов и пластмасс.
- Он также используется в электрогальванике для покрытия металлических поверхностей барием и предотвращения их окисления.
Применение BaCl2 в научных исследованиях
- Барий хлорид используется в химическом анализе для определения присутствия сульфатов, фосфатов и других ионов.
- Он также используется в биологических исследованиях для стимуляции культур клеток и проникновения в клетки с помощью ионного проникновения.
Барий хлорид (BaCl2) является многофункциональным соединением, которое эффективно применяется в разных отраслях промышленности и научных исследованиях. Его свойства и химический состав делают BaCl2 незаменимым для многих технических и научных целей.
Безопасность и риск использования Bacl2: токсичность и противопоказания
В первую очередь, Bacl2 является токсичным веществом и может вызывать различные негативные эффекты на организм. При попадании вещества на кожу, оно может вызвать раздражение и воспаление. При попадании на слизистые оболочки, Bacl2 может вызвать ожоги и воспаление.
Следует избегать попадания Bacl2 в глаза, так как это может привести к серьезным ожогам и повреждению зрения. При возникновении контакта с Bacl2 необходимо тщательно промыть зону контакта водой в течение нескольких минут и обратиться за медицинской помощью, если симптомы усиливаются или не исчезают.
При работе с Bacl2 рекомендуется использовать защитные средства, такие как резиновые перчатки, защитные очки и халат. Это поможет предотвратить контакт с веществом и снизить риск возникновения негативных последствий.
Также стоит отметить, что Bacl2 имеет противопоказания для определенных категорий людей. Например, беременным женщинам, лицам с аллергией на Bacl2 или проблемами с дыхательными путями не рекомендуется работать с этим веществом.
В целом, Bacl2 является химическим веществом, которое требует осторожного обращения и соблюдения мер безопасности. Неправильное использование Bacl2 или игнорирование безопасных методов работы с ним может привести к серьезным последствиям для здоровья. Поэтому рекомендуется ознакомиться с правилами безопасности и консультироваться с профессионалами перед началом работы с Bacl2.




