Взаимодействие металлов с растворами солей является одной из фундаментальных тем в химии. Это явление может иметь различные последствия и играет важную роль во многих процессах, как в природе, так и в промышленности.
Когда металл погружается в раствор соли, происходит реакция, которая может привести к образованию осадка, выделению газа или изменению цвета раствора. В некоторых случаях реакция может быть сопровождена выделением большого количества тепла или возгоранием.
Процесс взаимодействия металлов с растворами солей определяется рядом факторов, таких как электрохимические свойства металла и соли, концентрация раствора, температура и рН-среда. Изучение этих факторов позволяет понять и объяснить механизм реакции и предсказать итоговый результат.
Взаимодействие металлов с растворами солей

Взаимодействие металлов с растворами солей представляет собой химическую реакцию, при которой происходит обмен ионами между раствором солей и поверхностью металла. Эта реакция может приводить к различным результатам, в зависимости от химических свойств металла и соли.
Металлы могут реагировать с растворами солей, образуя осадки, растворы или газы. Например, реакция цинка с раствором медного(II) сульфата приводит к образованию осадка меди и обновлению цинковой поверхности. Это наблюдается при данной реакции, когда происходит обмен электронов между металлами.
Электрохимический ряд напряжений помогает определить, какие металлы могут реагировать с растворами солей. Металлы с более низкими значениями электродного потенциала могут вытеснить металлы с более высокими значениями, образуя осадок или выделяя газ.
- Реакция металла с раствором соли может быть полезной для различных процессов, таких как электрохимическое осаждение металлов.
- Взаимодействие металлов с растворами солей имеет большое значение в промышленных процессах, включая гальваностегию и гальваническое покрытие.
- Металлы могут также просто растворяться в растворе соли, образуя ионы металла в растворе. Например, магний растворяется в растворе хлорида магния, образуя ионы Mg2+.
Химия и реакции
Химия – это наука, изучающая строение, свойства и превращения вещества. Реакции, которые происходят между разными веществами, являются основой химии. Они проявляются в виде изменений состава и структуры вещества, что приводит к образованию новых веществ и появлению новых свойств.
Взаимодействие металлов с растворами солей – это одна из важных тем в химии. Реакции, которые происходят при этом взаимодействии, помогают понять свойства и характеристики различных металлов. Например, при погружении металла в раствор соли можно наблюдать выделение газов, изменение цвета раствора, образование осадка или изменение pH раствора.
Существуют разные типы реакций, которые могут происходить при взаимодействии металлов с растворами солей. Например, это могут быть реакции обмена, когда ионы металла вступают в обмен с ионами солей. Также возможны реакции окисления-восстановления, когда металл вступает в реакцию с ионами соли, меняя свой степень окисления.
Познание и изучение реакций в химии позволяет не только лучше понять механизмы взаимодействия веществ, но и применять полученные знания для различных целей. Например, на основе реакций металлов с растворами солей можно разработать эффективные методы очистки воды или получения ценных продуктов.
Коррозия металлов в растворах солей
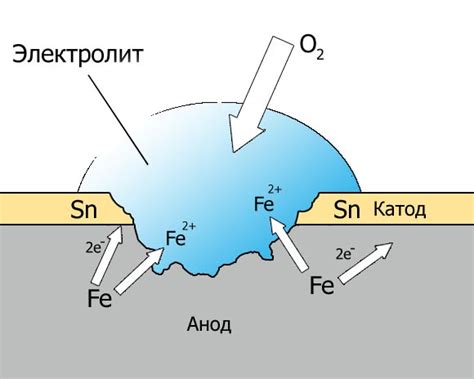
Коррозия металлов представляет собой процесс химического разрушения металлической поверхности под воздействием различных факторов. Один из наиболее распространенных факторов, способных вызвать коррозию, это взаимодействие металлов с растворами солей.
Под влиянием солей, металлы могут образовывать оксиды, гидроксиды или соли, что приводит к изменению их физических и химических свойств. Например, железо подвергается коррозии в кислых растворах солей, образуя ржавчину. Алюминий реагирует с растворами кислых солей, что приводит к образованию водорастворимых алюминатов и выделению водорода.
Коррозия металлов в растворах солей не только приводит к потере материала, но и может иметь серьезные последствия. Например, коррозия металлов в трубопроводах может привести к пробоям и разрушению системы. Поэтому очень важно принимать меры по защите металлических конструкций от коррозии, например, путем применения защитных покрытий или использования специальных ингибиторов коррозии.
Для изучения коррозии металлов в растворах солей проводятся множество исследований. В зависимости от конкретных условий, взаимодействие металлов с солями может протекать по разным механизмам. Некоторые металлы, например, медь, обладают высокой устойчивостью к коррозии, в то время как другие металлы, например, железо, очень подвержены коррозии.
В результате исследований коррозии металлов в растворах солей были разработаны различные методы защиты от коррозии. В настоящее время применяются различные защитные покрытия, а также проводятся работы по разработке новых материалов с улучшенными свойствами, стойкими к коррозии.
Процессы окисления и восстановления
Окисление и восстановление - это важные химические процессы, которые происходят при взаимодействии металлов с растворами солей. В процессе окисления металла он теряет электроны и образует положительные ионы, а восстановление, наоборот, включает передачу электронов от восстанавливающего агента к окисляющему, что приводит к уменьшению окислительного состояния металла.
Окисление является более активным процессом, при котором металл отдает электроны и превращается в положительный ион. Это происходит, когда реагирующий металл находится в присутствии окислителя - вещества, способного принимать электроны, такого как растворенные ионы кислорода или некоторые вещества, содержащие кислород.
Восстановление, напротив, является процессом, при котором вещество теряет окислительные свойства и получает электроны от восстанавливающего агента. В качестве восстанавливающих агентов могут выступать редуцирующие вещества, способные отдавать электроны, такие как металлы или растворенные ионы.
- Окисление и восстановление обычно происходят одновременно и называются редокс-реакциями, они имеют важное значение в химии, особенно при изучении взаимодействия металлов с растворами солей.
- Редокс-реакции могут иметь практическое применение - например, в процессе гальванизации при покрытии металлов защитной пленкой для предотвращения коррозии.
Процессы окисления и восстановления обладают большими значениями не только в химии, но и в инженерии и технологии, так как позволяют изменять свойства и улучшать характеристики материалов, используемых в различных областях промышленности.
Влияние pH на взаимодействие металлов и солей

Растворы солей могут иметь различные значения pH, которые влияют на взаимодействие металлов. pH — это мера кислотности или щелочности раствора и определяется количеством ионов водорода (H+) в растворе. Различные металлы могут проявлять различную реакцию на растворы с разным pH, что связано с их активностью и электрохимическими свойствами.
При нейтральном pH (около 7) некоторые металлы, такие как железо, медь, свинец, стабильны и не проявляют значительной реакции с растворами солей. Однако другие металлы, такие как цинк или алюминий, могут проявить активность и реагировать с растворами солей в нейтральной среде.
При кислом pH (менее 7) многие металлы, такие как алюминий и цинк, проявляют большую активность и реагируют с растворами солей, образуя ионы металла и выделяя водород. При этом может происходить коррозия металла и образование соответствующих оксидов или гидроксидов металла.
При щелочном pH (более 7) некоторые металлы, такие как алюминий или цинк, также могут проявить активность и реагировать с растворами солей. Однако при более высоком pH может происходить осаждение или гидролиз металла, что приводит к образованию осадка или гидроксида металла.
Таким образом, pH играет важную роль во взаимодействии металлов и солей. Значение pH определяет степень активности металла и образование соответствующих продуктов реакции. Понимание влияния pH на взаимодействие металлов и солей позволяет более точно прогнозировать и контролировать химические реакции и использование металлов в различных сферах промышленности и научных исследований.
Роль ионов водорода
Ионы водорода играют важную роль в химических реакциях между металлами и растворами солей. В процессе взаимодействия металлической поверхности с раствором соли, ионы водорода могут участвовать в различных реакциях, влияя на характер и скорость процесса.
Один из основных способов взаимодействия ионов водорода с металлами - это образование водородных ионов. При этом происходит окисление металла, а ионы водорода принимают на себя лишние электроны. В результате образуется пузырек водорода, который можно наблюдать на поверхности металла. Этот процесс называется гидролизом металла.
Также ионы водорода могут образовывать соединения с металлами, особенно с активными элементами, такими как натрий, калий, цинк и алюминий. Например, реакция между ионами водорода и алюминием приводит к образованию гидроксида алюминия, который является основным компонентом вещества, известного как щелочной алюминиевый гель.
Кроме того, ионы водорода могут влиять на растворимость солей, особенно тех, которые содержат щелочные или щелочноземельные металлы. При добавлении кислоты, ионы водорода реагируют с ионами металла в растворе, формируя нерастворимые соединения, которые выпадают в осадок.
В итоге, ионы водорода играют важную роль в химических реакциях между металлами и растворами солей. Они могут окислять металлы, образовывать соединения и влиять на растворимость солей, определяя характер и скорость процесса.
Взаимодействие различных степеней окисления металлов с солями
Металлы имеют различные степени окисления, которые определяют их химические свойства и способность взаимодействовать с растворами солей. Взаимодействие металлов с солями зависит от их электрохимического потенциала и способности к окислению или восстановлению.
Металлы с более высокими степенями окисления обычно более активны и имеют большую способность к окислению, поэтому они могут вступать в химические реакции с растворами солей. Например, металлы с высокими степенями окисления, такие как алюминий или железо, могут реагировать с солями, образуя соответствующие соли и осаждая металлический осадок.
Металлы с более низкими степенями окисления могут реагировать с растворами солей только в присутствии окислителя, такого как кислород или хлор. Например, металлы с низкими степенями окисления, такие как магний или цинк, образуют соли, взаимодействуя с кислородом или хлоридной кислотой. Однако без наличия окислителя они обычно стабильны и не реагируют с солями.
Металлы могут образовывать различные продукты реакции с растворами солей, в зависимости от конкретного металла и соли. Реакция металла с солью может приводить к осаждению металлического осадка, образованию новой соли или изменению степени окисления металла.
Взаимодействие металлов с растворами солей имеет широкий спектр применений в различных отраслях науки и технологии. Это может быть использовано, например, для получения металлических покрытий, проведения электрохимических реакций или очистки воды от ионов металлов. Понимание взаимодействия различных степеней окисления металлов с солями является важным для развития новых технологий и применений в химической исследовательской области.
Образование осадков и реакции диспропорционирования
В процессе взаимодействия металлов с растворами солей может происходить образование осадков. Осадок – это твердое вещество, которое выпадает из раствора в результате реакции между металлами и соответствующими ионами в растворе.
Образование осадков происходит, когда растворенные ионы металлов соединяются веществами, нерастворимыми в воде. Нерастворимость веществ зависит от их растворимости в воде и может быть определена с помощью таблицы растворимости.
Реакции диспропорционирования – это реакции, при которых одно вещество окисляется, а другое вещество одновременно восстанавливается. Такие реакции часто встречаются в химии металлов и могут приводить к образованию осадков или других продуктов реакции.
Примером реакции диспропорционирования может служить взаимодействие цинка с раствором соли железа(II). При этом реакции цинк окисляется, образуя ионы цинка Zn2+, а ионы железа(II) Fe2+ одновременно восстанавливаются до ионов железа(III) Fe3+. В результате образуется осадок, состоящий из гидроксида железа(III), а цинк растворяется в растворе.
Таким образом, образование осадков и реакции диспропорционирования являются важными процессами в химии металлов и могут использоваться в различных промышленных и научных целях.
Вопрос-ответ
Какие реакции происходят при взаимодействии металлов с растворами солей?
Взаимодействие металлов с растворами солей может привести к обменным, окислительно-восстановительным или нейтрализационным реакциям. Например, при взаимодействии цинка с раствором медной соли происходит обменная реакция, при которой цинк вытесняет медь из раствора и образуется цинковая соль. Также возможна реакция окисления металла, например, железа, когда оно окисляется воздухом, образуя ржавчину.
Какие металлы реагируют с растворами солей?
Реакция металлов с растворами солей зависит от их активности. Активные металлы, такие как натрий, калий, магний или алюминий, реагируют с большинством солей. Более реактивные металлы могут вытеснять менее реактивные из их растворов. Менее активные металлы, такие как медь, железо или свинец, могут реагировать только с определенными солями и образовывать осадки.
Какие продукты образуются при взаимодействии металлов с растворами солей?
При взаимодействии металлов с растворами солей образуются различные продукты, в зависимости от конкретной реакции. Если металл реагирует с солью, то образуется соль металла. Например, при реакции цинка с солью меди образуется цинковая соль. В некоторых случаях металл может образовывать осадок, который выпадает из раствора. Например, при взаимодействии железа с солью свинца образуется свинцовый осадок.
Какие факторы могут влиять на скорость реакции металлов с растворами солей?
Скорость реакции металлов с растворами солей может зависеть от нескольких факторов. Важным фактором является активность металла: более активные металлы обычно реагируют быстрее. Также скорость реакции может зависеть от концентрации соли или металла в растворе: более высокая концентрация может увеличить скорость реакции. Температура также может влиять на скорость реакции: обычно реакции протекают быстрее при повышенной температуре.
