Металлы III группы главной подгруппы периодической таблицы характеризуются своими уникальными физическими и химическими свойствами. В этой группе в основном находятся переходные металлы, которые обладают высокой пластичностью, прочностью и теплопроводностью. Эти металлы также обладают хорошими электропроводящими свойствами и способностью образовывать разнообразные соединения.
Одним из наиболее известных и распространенных металлов III группы является алюминий. Он обладает низкой плотностью, что делает его легким и прочным материалом для использования в различных отраслях промышленности. Алюминий также обладает высокой коррозионной стойкостью, что делает его незаменимым материалом в строительстве, производстве автотранспорта и других сферах деятельности.
Еще одним из важных металлов III группы является галлий. Этот металл обладает свойствами плавиться в узком диапазоне температур, что делает его незаменимым при создании терморегулирующих устройств, таких как термометры и термостаты. Галлий также обладает полупроводниковыми свойствами, что позволяет использовать его в электронике.
Металлы III группы главной подгруппы имеют широкий спектр применения в различных сферах промышленности и науки. Они обладают уникальными физическими и химическими характеристиками, которые делают их ценными и востребованными материалами. Благодаря своим свойствам, эти металлы являются основой для создания различных изделий и технологических процессов.
Описание химических свойств

Металлы третьей группы химического элементов из главной подгруппы отличаются своими уникальными химическими свойствами. Они имеют высокую активность и легко вступают в химические реакции.
Один из характерных признаков металлов третьей группы - их способность образовывать соли и оксиды. Например, алюминий, один из представителей этой группы, образует множество солей, таких как хлорид алюминия, сульфат алюминия и т.д. Эти соли используются в различных областях, включая производство пищевых добавок, лекарств и синтетических материалов.
Металлы третьей группы также обладают способностью образовывать комплексные соединения. В этих соединениях металл образует связь с другими молекулами или ионами, что придает им различные физические и химические свойства. Примером такого соединения является комлекс феррицианида железа(III) и калия, который используется в аналитической химии для определения ионов железа(III).
Еще одним химическим свойством металлов третьей группы является их способность к амфотерности. Это означает, что они могут взаимодействовать как с кислотами, так и с основаниями. Например, оксид алюминия может принимать участие в реакциях как с кислотами, образуя соли, так и с основаниями, образуя гидроксид алюминия.
Кроме того, металлы третьей группы обычно обладают высокой реакционной способностью с кислородом, серой и другими неметаллами. Они могут образовывать оксиды и сульфиды, которые имеют различные свойства и широко используются в различных областях промышленности.
Физические свойства металлов iii группы
Металлы iii группы главной подгруппы характеризуются рядом уникальных физических свойств. Одним из таких свойств является низкая плотность материалов этой группы. Например, алюминий, который является одним из самых известных металлов iii группы, имеет плотность всего 2,7 г/см³, что делает его на 2,7 раза легче стали. Это свойство делает алюминий очень популярным материалом для различных применений, от производства авиационных компонентов до упаковки продуктов.
Еще одним важным физическим свойством металлов iii группы является высокая теплопроводность. Медь, являющаяся представителем этой группы, обладает одной из самых высоких теплопроводностей среди всех металлов. Это свойство делает медь необходимым материалом для производства проводов и различных электронных компонентов, где требуется эффективное отвод тепла.
Другое важное физическое свойство металлов iii группы - высокая электропроводность. В основном это свойство присуще металлам этой группы благодаря наличию свободных электронов в их структуре. Это делает эти металлы неотъемлемой частью различных электрических систем и проводов.
Кроме того, металлы iii группы обладают высокой пластичностью и способностью к прокатке и штамповке. Это позволяет легко обрабатывать эти материалы и создавать из них различные изделия по заданной форме. Например, деформация алюминия позволяет создавать пластинки и профили в металлургии, а деформация железа позволяет создавать из него рельсы и профили для железнодорожного транспорта.
Применение металлов III группы

Металлы III группы главной подгруппы, такие как алюминий, галлий и индий, имеют широкий спектр применения благодаря своим уникальным свойствам и химическим характеристикам.
Одним из наиболее известных и широко применяемых металлов III группы является алюминий. Он отличается низкой плотностью, высокой прочностью и хорошей коррозионной стойкостью, что делает его идеальным материалом для различных отраслей промышленности. Алюминий используется в авиационной и автомобильной промышленности, строительстве, производстве электроники, пищевой и упаковочной промышленности.
Также металлы III группы главной подгруппы находят применение в производстве электронных устройств. Например, галлий используется в качестве полупроводникового материала в различных электронных приборах и солнечных батареях. Он обладает высокой электропроводимостью и позволяет создавать компактные и эффективные устройства.
Индий также широко используется в электронной промышленности. Он применяется в производстве жидкокристаллических дисплеев (ЖК-дисплеев) и светодиодов (Светодиодов), благодаря своей способности передавать электрический ток и свет.
В целом, металлы III группы главной подгруппы применяются в различных отраслях промышленности, включая авиацию, автомобилестроение, электронику и строительство. Их уникальные физические и химические свойства делают их востребованными и необходимыми материалами для современного мира.
Особенности электронной конфигурации
Элементы iii группы главной подгруппы периодической системы имеют особенности в своей электронной конфигурации, которые влияют на их химические свойства.
- Бор (В) имеет электронную конфигурацию 1s²2s²2p¹. Его внешний электрон находится в пустом 2p-подуровне, что делает его химически неполноценным металлом. Бор образует анионы в ряде своих соединений и проявляет кислотные свойства.
- Алюминий (Al) имеет электронную конфигурацию 1s²2s²2p⁶3s²3p¹. Его внешний электрон находится в третьем энергетическом уровне, что делает его химически активным металлом. Алюминий имеет высокую электроотрицательность и обладает свойствами амфотерного оксида и гидроксида, что позволяет ему взаимодействовать и с кислотами, и с щелочами.
- Галлий (Ga) имеет электронную конфигурацию 1s²2s²2p⁶3s²3p⁶4s²3d¹⁰4p¹. Галлий обладает слабыми металлическими свойствами и часто используется в полупроводниковой промышленности. Он способен образовывать катионы Ga³⁺ из-за отсутствия электронов в 4s-подуровне.
- Индий (In) имеет электронную конфигурацию 1s²2s²2p⁶3s²3p⁶4s²3d¹⁰4p⁶5s²4d¹⁰5p¹. Индий обладает химическими свойствами промежуточными между алюминием и оловом. Он имеет наибольшую электроотрицательность среди элементов iii группы.
- Таллий (Tl) имеет электронную конфигурацию 1s²2s²2p⁶3s²3p⁶4s²3d¹⁰4p⁶5s²4d¹⁰5p⁶6s²4f¹⁴5d¹⁰6p¹. Таллий находится в конце третьего периода периодической таблицы, и его электронная конфигурация имеет наибольшую сложность среди элементов iii группы. Таллий проявляет свойства как металла, так и полуметалла.
Таким образом, электронная конфигурация элементов iii группы главной подгруппы определяет их химические свойства и способность образовывать различные соединения.
Реакционная способность металлов III группы

Металлы III группы главной подгруппы обладают разнообразными химическими свойствами, что определяет их реакционную способность. Они характеризуются относительно низкой активностью, чего не хватает металлам I и II групп. Однако они все же проявляют реакции с кислородом, водой, кислотами и другими веществами.
Металлы III группы обычно не реагируют с водой при обычных условиях. Однако при нагревании они могут образовывать оксиды металла и выходить на реакцию. Например, гидроксид алюминия (Al(OH)3) можно получить при взаимодействии алюминия с водой.
- Взаимодействие с кислородом: металлы III группы могут окисляться при контакте с кислородом воздуха. Например, алюминий окисляется до оксида алюминия (Al2O3) при нагревании в присутствии кислорода.
- Взаимодействие с кислотами: металлы III группы, в основном, проявляют активность при взаимодействии с кислотами средней силы. Например, алюминий может растворяться с выделением водорода в соляной кислоте.
- Взаимодействие с щелочами: некоторые металлы III группы, например, галлий и индий, способны реагировать с щелочами, образуя соответствующие соли и выделяя водород. Например, индий при реакции с гидроксидом натрия (NaOH) образует индий(III)гидроксид (In(OH)3) и выделяется водород.
Также можно выделить реакцию металлов III группы с неметаллами, например, хлором, серой и другими. Эти реакции приводят к образованию соответствующих соединений, которые могут иметь различные свойства и применения.
Описание химических соединений металлов iii группы
Металлы iii группы главной подгруппы характеризуются образованием различных химических соединений, включающих в себя соединения с кислородом, серой, азотом, фосфором и другими элементами. Важными химическими соединениями являются оксиды, сульфиды, азиды и гидроксиды.
Оксиды, образованные металлами iii группы, характеризуются высокой термической стабильностью. В реакциях с кислородом металлы третьей группы образуют преимущественно двухвалентные оксиды. Например, оксид алюминия Al2O3 является одним из самых распространенных оксидов металлов iii группы. Он обладает высокой твердостью и широко применяется в качестве абразивного материала.
Сульфиды металлов iii группы представляют собой соединения металла с серой. Они имеют различные физические и химические свойства. Например, сульфид железа FeS встречается в природе в виде минерала пирита. Известно также множество полихалкогенидов металлов iii группы, включающих в себя различные комбинации серы, селена и теллура.
Азиды металлов iii группы являются солями азотистоводородной кислоты и обладают высокой запальной способностью. Азид алюминия AlN, например, может быть использован в качестве взрывчатого вещества или в составе взрывных смесей.
Гидроксиды металлов iii группы представляют собой соединения металла с гидроксидной группой. Они обладают щелочными свойствами и являются основными оксикислотами. Например, гидроксид алюминия Al(OH)3 является одним из самых распространенных гидроксидов металлов iii группы и используется в промышленности для производства алюминия.
Сравнение металлов iii группы главной подгруппы
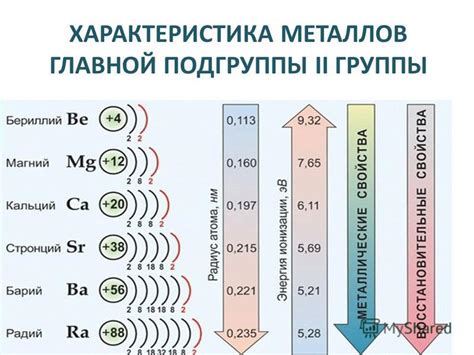
Группа металлов iii главной подгруппы включает в себя такие элементы, как скандий (Sc), иттрий (Y) и лантан (La), а также редкоземельные элементы. В этой группе металлы обладают рядом общих характеристик, но также имеют и свои отличительные особенности.
Скандий является серебристо-белым металлом с относительно низкой плотностью. Он хорошо реагирует с кислородом воздуха, что приводит к образованию оксида скандия. Скандий не выделяется в природе в чистом виде, часто встречается в рудах и минералах. Он используется в производстве алюминиевых сплавов, в технике световых эффектов и в ядерной технологии.
Иттрий также является серебристо-белым металлом, но его плотность выше, чем у скандия. Иттрий является важным компонентом различных сплавов, таких как алюминиево-иттриевые сплавы, которые используются в авиационной промышленности. Также, иттрий используется в производстве лазеров и в синтетическом производстве алмазов.
Лантан является серебристо-белым металлом с мягкой текстурой. Он реактивен с водой и кислородом воздуха, что приводит к образованию оксида лантана. Лантан используется в производстве стекла, электродов и фотоэлементов, а также в катализаторах и магнетронах.
Сравнивая металлы iii группы главной подгруппы, можно сказать, что скандий, иттрий и лантан обладают схожими химическими свойствами, но имеют различия в своей физической структуре и использовании. Каждый из этих металлов имеет свои уникальные свойства и находит применение в различных областях промышленности и науки.
Вопрос-ответ
Какие металлы относятся к iii группе главной подгруппы?
К иии группе главной подгруппы относятся такие металлы, как галлий (Ga), индий (In) и таллий (Tl).
Какие характеристики металлов iii группы главной подгруппы?
Металлы iii группы главной подгруппы обладают низкой твердостью, низкой температурой плавления и высокой плотностью. Они также характеризуются хорошей проводимостью электрического тока и тепла.
Каковы основные свойства галлия?
Галлий является мягким и низкотемпературным металлом. Он имеет серебристый цвет и низкую температуру плавления (29,76 °C), что делает его жидким при комнатной температуре. Галлий эластичный и хороший проводник электричества.
Какие применения имеет индий?
Индий используется в различных областях. Он применяется в электронике в виде покрытий и пайки на поверхности контактов, а также в производстве солнечных батарей. Индийшиоу ис пока, как опережающий.
