Взаимодействие кислот с металлами является важной темой в химии и имеет широкое применение в различных областях науки и технологий. Одной из таких реакций является взаимодействие кислоты с металлом цинком (Zn). Металл цинк – это один из самых распространенных металлов на Земле, широко используемый в различных отраслях промышленности.
Когда кислота вступает в контакт с металлом цинком, происходит его реакция с образованием соли и выделением водорода. Это типичная реакция обмена, которая классифицируется как реакция нейтрализации. В результате этой реакции образуется соль, состоящая из положительно заряженного иона металла и негативно заряженного иона кислоты.
Соляная кислота (HCl) – одна из наиболее распространенных кислот, широко используемая в различных химических процессах и производствах. При взаимодействии с металлом цинком образуется хлорид цинка (ZnCl2) и выделяется молекулярный водород (H2). Образование соли и выделение газа – это типичные результаты данного взаимодействия.
Таким образом, реакция взаимодействия кислоты с металлом цинком и соляной кислоты представляет собой реакцию нейтрализации, при которой образуются соль и молекулярный водород. Такие реакции имеют большое значение в химии и являются основой многих процессов и технологий.
Взаимодействие кислоты с металлом Zn

Металл Zn (цинк) является активным металлом, который проявляет высокую реакционную способность при взаимодействии с кислотами. Реакция происходит с выделением водорода и образованием соответствующих солей.
Например, при взаимодействии соляной кислоты (HCl) с цинком образуется хлорид цинка (ZnCl2) и выделяется молекулярный водород (H2). Реакция протекает с образованием пузырьков газа и выделением тепла.
Уравнение реакции выглядит следующим образом:
Zn (цинк) + 2 HCl (соляная кислота) → ZnCl2 (хлорид цинка) + H2 (водород)
Данная реакция является примером взаимодействия металла с кислотой, при котором металл отдает электроны, а водородные ионы из кислоты принимают эти электроны. Это приводит к образованию ионов металла в растворе и выделению газа.
Взаимодействие кислоты с металлом Zn широко применяется в химических реакциях и лабораторных экспериментах. Также, цинк используется в различных промышленных процессах, включая гальваническое покрытие, производство сплавов и другие технологии. Взаимодействие кислоты с металлом Zn является одним из основных способов получения цинковых соединений.
Химические свойства кислоты
1. Общая характеристика:
Кислоты - это химические соединения, способные отдавать протоны (водородные ионы) и реагировать с основаниями для образования солей. Они обладают кислотными свойствами и могут вызывать коррозию металлов, причинять вред живым организмам и изменять химические свойства веществ.
2. Кислотные свойства:
Основные кислотные свойства кислот заключаются в их реакции с металлами, оксидами, основаниями и другими веществами. Они способны растворять металлы, образуя соли и выделяя водород. Кислоты также реагируют с щелочами и основаниями, образуя соли и воду.
3. Реакции кислот с металлами:
Кислоты реагируют с металлами, образуя соли и выделяя водород. Например, реакция соляной кислоты с металлом цинка (Zn) приводит к образованию хлорида цинка и выделению водорода: Zn + 2HCl = ZnCl2 + H2.
4. Реакции кислот с основаниями:
Кислоты реагируют с основаниями, образуя соли и воду. Например, реакция соляной кислоты с гидроксидом натрия (NaOH) приводит к образованию хлорида натрия и воды: HCl + NaOH = NaCl + H2O.
5. Реакции кислот с оксидами:
Кислоты реагируют с оксидами, образуя соли и воду. Например, реакция серной кислоты с оксидом алюминия (Al2O3) приводит к образованию сульфата алюминия и воды: H2SO4 + Al2O3 = Al2(SO4)3 + H2O.
6. Уровень кислотности:
Кислотность измеряется pH-метром и определяется по концентрации водородных ионов. Кислотность может быть разной, от сильно кислых (низкий pH) до слабо кислых (высокий pH). Например, соляная кислота имеет низкий pH, а лимонный сок - слабо кислый.
7. Коррозия металлов:
Кислоты способны вызывать коррозию металлов путем образования солей и выделения водорода. Коррозия может наносить серьезный вред металлическим конструкциям, а также повреждать металлические предметы в быту и промышленности.
Физические свойства металла Zn

Цвет и блеск: Металл Zn обладает серебристо-белым цветом в свежесрезанном состоянии. Однако при длительном хранении на воздухе на его поверхности появляется слой окиси, из-за чего металл приобретает сероватый оттенок.
Плотность: Плотность металла Zn составляет около 7,14 г/см³. Это относительно низкое значение позволяет использовать его в различных отраслях промышленности, где требуется легкость материала.
Термические свойства: Температура плавления металла Zn составляет примерно 419,5 °C, что делает его одним из самых низкоплавких металлов. При повышении температуры он образует густую корку окиси, которая может защищать его от дальнейшего окисления.
Проводимость: Металл Zn обладает довольно низкой электропроводностью. Он входит в группу так называемых полу-металлов. Однако его хорошие свойства термической проводимости обусловили его использование в производстве различных металлических изделий.
Магнитные свойства: Металл Zn не обладает магнитными свойствами.
Стойкость к коррозии: Металл Zn стойкий к коррозии воздухом и водой. Он образует на своей поверхности пассивную пленку окиси, которая защищает его от дальнейшего окисления и коррозии. Тем не менее, при длительном воздействии влаги или агрессивных сред могут возникать процессы окисления и порчи металла.
Сплавляемость: Металл Zn хорошо сплавляется с другими металлами, такими как медь и алюминий. Сплавы на основе металла Zn обладают высокой прочностью и стойкостью к коррозии.
Реактивность: Металл Zn активен химически и может реагировать с различными веществами, такими как кислоты, щелочи, водород, кислород прямыми или редокс-реакциями.
Применение: Металл Zn широко используется в различных областях промышленности, таких как производство гальванических покрытий, производство литейных сплавов, в частности, используется для создания огнеупорных материалов, а также в производстве аккумуляторных элементов и других электротехнических изделий.
Реакция металла Zn с кислотой
Металл Zn (цинк) является активным химическим элементом, который легко реагирует с кислотами, включая соляную кислоту. Реакция металла Zn с кислотой является классическим примером взаимодействия металла и кислоты.
При взаимодействии металла Zn с соляной кислотой (HCl) происходит образование соли цинка и выделение водорода. Реакцию можно представить следующим образом:
Zn + 2HCl → ZnCl2 + H2
То есть, одна молекула цинка реагирует с двумя молекулами соляной кислоты, образуя одну молекулу хлорида цинка и выделяя одну молекулу водорода.
Реакция между металлом Zn и кислотой является быстрой и энергичной, сопровождается выделением пузырьков газа. Образование соли цинка и выделение водорода являются характерными признаками такого типа реакций.
Реакция между металлом Zn и кислотой широко используется в химических исследованиях, а также в промышленности. Наряду с соляной кислотой, металл Zn также может реагировать с другими кислотами, например, серной или азотной.
Общая схема реакции

Взаимодействие кислоты с металлом Zn и соляной кислотой происходит по общей схеме химической реакции, которая можно описать следующим образом:
- Сначала происходит диссоциация кислоты, при которой происходит разделение вещества на положительные и отрицательные ионы. В данном случае, соляная кислота (HCl) диссоциирует на положительные ионы водорода (H+) и отрицательные ионы хлорида (Cl-).
- Далее, металл Zn взаимодействует с положительными ионами водорода, образуя адсорбированный слой водорода на поверхности металла. Это является промежуточным этапом реакции.
- При втором этапе происходит диссоциация воды на положительные ионы водорода (H+) и отрицательные ионы гидроксида (OH-). Положительные ионы водорода адсорбируются на поверхность металла и реагируют с отрицательными ионами хлорида (Cl-), образуя молекулы соляной кислоты.
- Образовавшиеся молекулы соляной кислоты растворяются в воде и их частицы диссоциируют, образуя положительные ионы водорода (H+) и отрицательные ионы хлорида (Cl-).
- Реакция заканчивается, когда все реагенты полностью растворятся и прекратят взаимодействовать друг с другом.
Таким образом, общая схема реакции взаимодействия кислоты с металлом Zn и соляной кислотой включает диссоциацию кислоты, адсорбцию ионов водорода на поверхности металла и образование молекул соляной кислоты. В результате реакции образуются положительные ионы водорода и отрицательные ионы хлорида.
Выделение водорода
Выделение водорода - это одна из важнейших реакций взаимодействия кислоты с металлом Zn и соляной кислотой. При смешении кислоты и металла Zn происходит химическая реакция, в результате которой образуется водородный газ.
Реакция выделения водорода протекает по следующей схеме:
- Металл Zn реагирует с соляной кислотой, образуя соль и водород.
- Уравнение реакции выглядит следующим образом: Zn + 2HCl = ZnCl2 + H2.
- Металл Zn окисляется, отдавая электроны, а молекулы соляной кислоты HCl получают электроны, в результате образуется ион водорода H+.
- Ион водорода реагирует с молекулой воды, образуя молекулу водорода H2.
- Выделяющийся водород является газообразным и обладает характеристическим запахом.
Реакция выделения водорода широко используется в промышленности для получения водорода, который находит применение в процессах водородации, производстве аммиака и других химических реакциях.
Образование соли
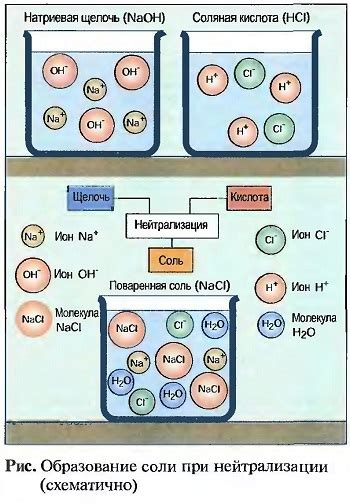
В результате реакции взаимодействия кислоты с металлом Zn и соляной кислотой образуется соль. Образование соли является одной из основных химических реакций, происходящих при взаимодействии кислоты с металлом и соляной кислотой.
Соль образуется в результате обменной реакции, при которой ионы металла из металла Zn или водородный катион замещают катион и анион кислоты. При этом происходит отщепление водорода от кислоты и образование соответствующего кислотного остатка.
Образование соли является эндотермической реакцией, сопровождающейся выделением тепла. В процессе реакции происходит осадка соли в виде твердого вещества. Это может быть заметно, например, при взаимодействии соляной кислоты с цинком, когда образовавшийся осадок окрашивается в белый цвет.
Реакция образования соли является важным процессом в химии, так как соли широко используются в различных отраслях промышленности, медицине и быту. Они служат основой для получения других веществ и находят применение в процессах синтеза и обработки материалов.
Взаимодействие кислоты с соляной кислотой
Взаимодействие кислоты с соляной кислотой представляет собой один из основных процессов химической реакции. Соляная кислота (HCl) является одной из самых распространенных и сильных минеральных кислот.
Когда кислота вступает в реакцию с соляной кислотой, происходит образование соли и выделение водорода. Такая реакция называется нейтрализацией. В случае с соляной кислотой, образуется хлорид металла и вода.
Например, при взаимодействии соляной кислоты с цинком (Zn), образуется хлорид цинка (ZnCl2) и выделяется водородный газ (H2). Реакция протекает с выделением тепла и характеризуется химическим уравнением:
Zn + 2HCl -> ZnCl2 + H2 ↑
Такое взаимодействие кислоты с соляной кислотой может иметь практическое применение. Например, для получения хлорида цинка используется различные методы, включающие взаимодействие цинка и соляной кислоты.
В заключение, взаимодействие кислоты с соляной кислотой является химической реакцией, при которой образуется соль и выделяется водород. Этот процесс применим в различных областях, включая производство химических соединений и получение исходных материалов.
Химические свойства соляной кислоты

Соляная кислота (хлороводородная кислота) — одна из самых распространенных и известных кислот, применяемая в различных сферах нашей жизни. В этом абзаце мы рассмотрим основные химические свойства данного вещества.
Свойство 1: Соляная кислота обладает ярко выраженными кислотными свойствами. Она легко реагирует с металлами, образуя соли и выделяя водород. Например, при взаимодействии с металлом цинком (Zn), образуется хлорид цинка (ZnCl2) и выделяется водородный газ (H2).
Свойство 2: Соляная кислота является сильным окислителем и может взаимодействовать с различными веществами. Например, она окисляет сернистый ангидрид (SO2) до серной кислоты (H2SO4), а также обладает способностью окислять металлы, например железо (Fe), образуя хлорид железа (FeCl2).
Свойство 3: Кислота образует характерные соли, называемые хлоридами. Например, соляная кислота соединяется с натрием (Na) и образует хлорид натрия (NaCl), который широко применяется в пищевой промышленности.
Свойство 4: Соляная кислота обладает высокой растворимостью в воде. При разбавлении она выделяет большое количество тепла. Раствор соляной кислоты обладает высокой кислотностью и может вызывать ожоги, поэтому необходимо соблюдать осторожность при работе с ней.
| Вещества | Реакция |
|---|---|
| Соляная кислота (HCl) | HCl + Zn → ZnCl2 + H2↑ |
В заключение: соляная кислота обладает множеством химических свойств, которые определяют ее широкое применение в различных отраслях науки и промышленности. Она является сильной кислотой, окислителем и образует характерные соли. При работе с ней необходимы осторожность и соблюдение правил безопасности.
Вопрос-ответ
Что происходит при взаимодействии кислоты с металлом Zn?
При взаимодействии кислоты с металлом Zn происходит реакция образования соли и выделения водорода. Кислота передает свои протоны (H+) металлу, образуя соль, а при этом выделяется водород газ.
Какие продукты образуются при реакции кислоты с металлом Zn?
При реакции кислоты с металлом Zn образуются соль и водород. Кислота отдает свои протоны металлу и образует соль, а при этом выделяется водород газ.
Какова формула соли, образующейся при взаимодействии кислоты со металлом Zn?
Формула соли, образующейся при взаимодействии кислоты со металлом Zn, зависит от самой кислоты. Например, при взаимодействии соляной кислоты (HCl) с металлом Zn образуется соль цинка(II) хлорида (ZnCl2).
Возможно ли взаимодействие других кислот с металлом Zn?
Да, возможно взаимодействие других кислот с металлом Zn. Некоторые кислоты также могут передавать свои протоны металлу и образовывать соли. Например, серная кислота (H2SO4) может образовывать соль цинка(II) сульфата (ZnSO4).
Для чего нужно взаимодействие кислоты с металлом Zn?
Взаимодействие кислоты с металлом Zn может использоваться в различных процессах и реакциях. Например, это может быть одним из способов получения солей или выделения водорода газа. Также такие реакции могут выполняться в аналитических целях для определения наличия и количества кислоты или металла в растворе.
