Атомы металлов являются основными строительными блоками материи. Они обладают широким спектром свойств и играют ключевую роль в различных сферах нашей жизни. Один из важных аспектов структуры атомов металлов – схема завершения их внешнего энергетического уровня.
Внешний энергетический уровень атома металла определяет его химические свойства и способность к вступлению в реакции с другими веществами. Для завершения этого уровня атомы металлов могут использовать различные схемы. Одним из наиболее распространенных подходов является схема завершения внешнего энергетического уровня через образование катионов.
Катионы – положительно заряженные атомы металлов, которые образуются путем потери одного или нескольких электронов. Такая схема завершения внешнего энергетического уровня позволяет атому металла достигнуть стабильности и получить электронную конфигурацию инертного газа. Однако, не все атомы металлов предпочитают использовать эту схему. В зависимости от своей электронной конфигурации и химических свойств, атомы металлов могут выбирать другие подходы для завершения своего внешнего энергетического уровня.
Схема завершения - внешний энергетический уровень
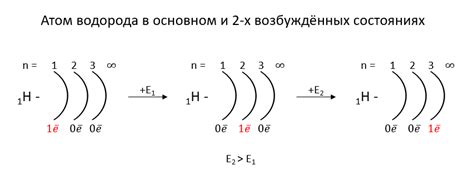
Схема завершения внешнего энергетического уровня атомов металлов отражает расположение электронов на внешнем энергетическом уровне, который максимально наполнен в соответствии с принципом Паули. Электроны внешнего уровня определяют химические свойства металлов и их взаимодействие с другими веществами.
Схема завершения внешнего энергетического уровня атомов металлов имеет определенные особенности. Обычно на внешнем уровне находятся от одного до четырех электронов. Например, при атомном номере 11 у меди на внешнем уровне располагается один электрон, у железа (26) – два электрона, у марганца (25) – пять электронов, и т.д.
Схема завершения внешнего энергетического уровня атомов металлов может представляться в виде таблицы.
| Металл | Атомный номер | Количество электронов на внешнем уровне |
|---|---|---|
| Натрий | 11 | 1 |
| Железо | 26 | 2 |
| Марганец | 25 | 5 |
| Алюминий | 13 | 3 |
Схема завершения внешнего энергетического уровня атомов металлов является основой для описания химических свойств металлов и их реакционной способности. Сочетание электронов на внешнем уровне и их взаимодействие с электронами других атомов определяют формирование химических связей и образование соединений металлов.
Атомы металлов
Атомы металлов представляют собой основные строительные блоки металлических элементов. Они имеют особую структуру, которая позволяет им обладать высокой электропроводностью и способностью образовывать кристаллическую решетку.
Внешний энергетический уровень атомов металлов часто содержит несколько электронов, которые могут легко перемещаться между атомами и создавать электрический ток. Это связано с тем, что внешний энергетический уровень у металлов обычно не полностью заполнен, что делает их хорошими проводниками электричества и тепла.
Схема завершения внешнего энергетического уровня атомов металлов может быть различной в зависимости от элемента. Некоторые атомы металлов имеют один или два электрона на внешнем энергетическом уровне, а другие могут иметь до восьми электронов.
Завершение внешнего энергетического уровня атомов металлов происходит за счет образования ионов с положительным зарядом. В процессе образования ионов атомы отдают или принимают электроны, чтобы заполнить или опустошить свой внешний энергетический уровень.
Атомы металлов могут также образовывать кристаллические решетки, в которых каждый атом окружен другими атомами, образуя регулярную структуру. Это позволяет металлам обладать высокой прочностью и пластичностью.
В целом, атомы металлов играют важную роль во многих областях науки и промышленности. Изучение и понимание их структуры и свойств позволяет разрабатывать новые материалы и улучшать существующие технологии.
Выбор подходящей схемы
Внешний энергетический уровень атомов металлов играет ключевую роль в их химических свойствах и реактивности. Выбор подходящей схемы завершения внешнего энергетического уровня является важным аспектом в разработке электронных устройств и материалов с определенными свойствами. В этом процессе учитываются различные факторы, такие как класс элемента, конфигурация электронных оболочек и химические связи.
Один из основных подходов к выбору схемы завершения внешнего энергетического уровня - это анализ свойств элементов в таблице периодов. Например, вещества, обладающие одним валентным электроном на внешнем энергетическом уровне, могут формировать ионы с единичным положительным зарядом. Такие ионы могут быть включены в соединения с другими элементами, образуя структуры с определенными химическими свойствами.
Еще одним подходом может быть анализ размера атомов металлов и их электронной конфигурации. Большинство металлов имеют большие радиусы атомов, что позволяет им образовывать ионы с положительными зарядами и легко обмениваться электронами с другими элементами. В таких случаях, схема завершения внешнего энергетического уровня может быть определена на основе их реакционной активности и способности образовывать соединения со стабильными химическими связями.
Иногда выбор подходящей схемы завершения внешнего энергетического уровня требует более сложных аналитических методов и компьютерных моделей. Например, может быть проведен анализ энергетических уровней и квантовых свойств электронов в электронных оболочках атомов металлов. Такие исследования помогают определить, какие энергетические состояния и связи наиболее стабильны и какие схемы завершения внешнего энергетического уровня будут наиболее предпочтительны для данного металла.
Принимая во внимание энергетический уровень
Энергетический уровень атома металла играет важную роль в его химических свойствах и реакциях. Процесс завершения энергетического уровня атомов металлов может быть представлен в виде схемы, которая помогает лучше понять и объяснить данное явление.
Завершение внешнего энергетического уровня атома металла происходит путем заполнения его внешней оболочки электронами. Последний энергетический уровень называется валентным уровнем. На этом уровне располагаются электроны, которые участвуют в химических реакциях металла.
Принимая во внимание энергетический уровень атома металла, можно установить его валентность и предсказать его химическое поведение. Число электронов на валентном уровне определяет, сколько атомов металла может образовать связи с другими атомами. Это может быть полезной информацией при изучении реакций металлов с другими веществами.
Схема завершения внешнего энергетического уровня атомов металлов может быть представлена в виде таблицы, в которой указаны атомные номера металлов и количество электронов на их валентных уровнях. Такая таблица помогает легко сопоставлять различные металлы и их химические свойства.
Влияние на химические свойства металлов

Химические свойства металлов определяются их электронной структурой и способностью вступать в реакции с другими веществами. Металлы обладают множеством уникальных свойств, которые делают их важными в различных областях промышленности и науки.
Одним из важных факторов, влияющих на химические свойства металлов, является их внешний энергетический уровень. Он определяет, какие энергетические уровни электронов находятся в заполненном состоянии и какие могут быть заняты. Это в свою очередь влияет на взаимодействие металла с другими веществами.
Кроме того, более высокий внешний энергетический уровень металла обеспечивает большее количество свободных электронов, которые способны проводить ток. Эта свойство делает металлы отличными проводниками электричества и тепла.
Также внешний энергетический уровень металлов может влиять на их реакционную способность. Высокий уровень может обуславливать возможность металла вступать в реакции с кислородом, водой или другими веществами, что может приводить к образованию окислов, гидроксидов или солей.
В заключение, внешний энергетический уровень металлов играет важную роль в их химических свойствах. Он определяет какие электронные состояния доступны для взаимодействия с другими веществами и способность металла проводить ток. Эти свойства делают металлы неотъемлемой частью нашей жизни и они находят множество применений в различных сферах.
Расположение атомов внешнего энергетического уровня
Внешний энергетический уровень атома металла представляет собой область, в которой находятся электроны, вовлеченные в химические реакции и взаимодействия с другими атомами. Расположение этих электронов на данный уровень имеет важное значение для определения химических свойств металлических элементов.
Обычно внешний энергетический уровень атомов металлов заполняется по принципу энергетического минимума, то есть сначала заполняются самые нижние энергетические уровни. В результате, атомы металлов имеют сложные энергетические структуры, состоящие из нескольких подуровней, каждый из которых может содержать разное количество электронов.
Расположение атомов внешнего энергетического уровня в металлах определяет их химическую активность, способность к реакциям и образованию связей с другими атомами. Обычно внешним энергетическим уровнем атомов металлов является s- или p-подуровень, который может содержать от одного до восьми электронов.
Заполнение внешнего энергетического уровня происходит в соответствии с правилом Клечковского, которое устанавливает порядок заполнения подуровней электронами в соответствии с их энергией. Например, для s-подуровней сначала заполняется подуровень с наименьшей энергией, а затем постепенно заполняются подуровни с более высокой энергией.
Отличия завершения уровня атомов различных металлов

Завершение внешнего энергетического уровня атомов металлов играет важную роль в определении их химических и физических свойств. Под внешним энергетическим уровнем понимается последний заполненный уровень электронов в атоме, который определяет его реактивность и способность образовывать химические соединения.
Основным фактором, определяющим различное завершение уровня атомов металлов, является количество электронов на этом уровне. Некоторые металлы, такие как железо и никель, имеют 2 электрона на внешнем уровне и стремятся к завершению этого уровня путем потери или приобретения 2 электронов. Такие металлы обладают высокой реактивностью и образуют ионы с зарядом +2 или -2.
В то же время, другие металлы, например, цинк и серебро, имеют одно электрон на внешнем уровне и стремятся к завершению этого уровня путем потери или приобретения 1 электрона. Эти металлы также обладают высокой реактивностью, но образуют ионы с зарядом +1 или -1.
Кроме того, некоторые металлы могут образовывать ионы с различными зарядами, в зависимости от условий. Например, железо может образовывать ионы Fe2+ и Fe3+, в зависимости от количества потерянных электронов. Это свойство металлов позволяет им образовывать различные химические соединения и влиять на их физические свойства, такие как цвет и магнитные свойства.
Таким образом, различия в завершении внешнего энергетического уровня атомов металлов определяют их химические и физические свойства и являются важными факторами при изучении и использовании этих материалов.
Рациональный выбор схемы
Схема завершения внешнего энергетического уровня атомов металлов имеет большое значение для эффективности их взаимодействия с другими атомами и молекулами. Рациональный выбор подходящей схемы обеспечивает достижение оптимальных результатов в различных процессах, таких как катализ, синтез химических соединений или проведение электрохимических реакций.
При выборе схемы завершения внешнего энергетического уровня атомов металлов необходимо учитывать их электронную конфигурацию, а также особенности соединений, в которых они будут участвовать. Например, при синтезе сложных органических соединений может быть полезно выбрать такую схему, которая обеспечивает наличие свободных электронов на поверхности металла, что способствует его катализирующей активности.
Для определения рациональной схемы завершения внешнего энергетического уровня атомов металлов можно использовать различные методы, включая теоретическое моделирование, экспериментальные исследования и анализ уже существующих знаний в данной области. Каждый из этих подходов имеет свои преимущества и ограничения, поэтому целесообразно использовать комплексный подход, позволяющий получить наиболее точную и полную информацию о возможных схемах завершения внешнего энергетического уровня атомов металлов.
Возможные исключения и особенности

В процессе завершения внешнего энергетического уровня атомов металлов могут возникать определенные исключения и особенности, которые не всегда соответствуют общей схеме.
Одним из возможных исключений является наличие недостаточного числа электронов для полного заполнения последнего энергетического уровня. В этом случае атом металла может образовать положительный ион, лишившись одного или нескольких электронов.
Еще одной особенностью может быть наличие свободных электронов на внешнем энергетическом уровне. В некоторых случаях свободные электроны достаточно свободны и могут двигаться по металлической решетке, образуя так называемую "электронную оболочку". Это явление объясняет характерные свойства металлов, такие как электропроводность и теплопроводность.
Некоторые металлы также могут образовывать полинуклеиды, в которых количество электронов на последнем энергетическом уровне может быть больше, чем предусмотрено общей схемой завершения. Например, у металла циркония на последнем энергетическом уровне может находиться 10 электронов, вместо обычных 8.
Важно отметить, что схема завершения внешнего энергетического уровня атомов металлов является общей и может быть вариативной в зависимости от конкретных условий исследуемой системы.
Вопрос-ответ
Какова схема завершения внешнего энергетического уровня атомов металлов?
Схема завершения внешнего энергетического уровня атомов металлов может быть разной, но часто встречается схема завершения уровня s2 p6 d10 f14.
Почему схема завершения внешнего энергетического уровня атомов металлов может быть разной?
Схема завершения внешнего энергетического уровня атомов металлов зависит от их расположения в периодической системе элементов и конфигурации электронных оболочек.
Какие элементы имеют схему завершения уровня s2 p6 d10 f14?
Элементы, находящиеся в блоках s, p, d, f периодической системы элементов, могут иметь схему завершения уровня s2 p6 d10 f14. Например, металлы из блока d, такие как железо или медь, имеют эту схему.
Какие атомы металлов имеют схему завершения уровня d10?
Только атомы металлов из блока d периодической системы элементов могут иметь схему завершения уровня d10. Например, никель или палладий имеют такую схему.
Какая схема завершения внешнего энергетического уровня характерна для атомов металлов блока s?
Схема завершения уровня s2 характерна для атомов металлов блока s периодической системы элементов. Например, кальций или магний имеют такую схему.
Какие атомы металлов могут иметь схему завершения уровня p6?
Схема завершения уровня p6 может быть у атомов металлов блока p периодической системы элементов. Например, свинец или олово имеют такую схему.
Какие элементы имеют схему завершения уровня f14?
Только элементы блока f периодической системы элементов могут иметь схему завершения уровня f14. Например, лантан или прометий имеют такую схему.
