В химии существует множество реакций, которые обусловлены взаимодействием различных веществ. Одной из таких реакций является взаимодействие серной кислоты (H2SO4) с оксидами металлов. Данная реакция имеет свои особенности и находит свое применение в различных областях нашей жизни.
Серная кислота (H2SO4) является одним из основных химических веществ и является сильным окислителем. В реакции с оксидами металлов, таких как оксид железа (Fe2O3) или оксид алюминия (Al2O3), происходит образование соответствующих сульфатов металлов и выделение тепла. Эта реакция можно описать следующим образом:
H2SO4 + МO → МSO4 + H2O + Q,
где М - металл, а Q - тепло, выделяющееся в процессе реакции.
Применение данной реакции широко разнообразно. В промышленности она используется для получения различных сульфатов металлов, которые в дальнейшем могут использоваться в производстве различных материалов. Например, сульфат железа (FeSO4) применяется в медицине как препарат для лечения анемии, а также в сельском хозяйстве в качестве удобрения. Сульфат алюминия (Al2(SO4)3) используется в процессах очистки воды и производстве бумаги.
Таким образом, реакция взаимодействия H2SO4 с оксидами металлов имеет свои особенности и находит широкое применение в различных сферах нашей жизни. Способность серной кислоты выступать в роли окислителя позволяет получать различные сульфаты металлов, которые широко используются в промышленности, медицине и сельском хозяйстве.
Важность и особенности реакции оксидов металлов с H2SO4
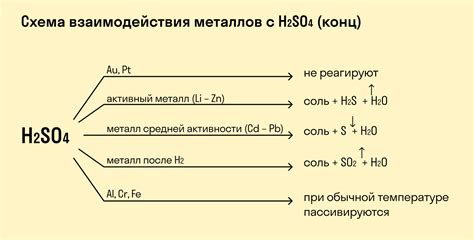
Реакция оксидов металлов с H2SO4 является важным процессом в химической промышленности и лабораторных исследованиях. Она позволяет получать соли металлов и сульфаты, которые находят широкое применение в различных сферах жизни.
Особенности данной реакции заключаются в том, что оксиды металлов — это химические соединения, содержащие кислород и металлический элемент. Реакция с H2SO4 происходит путем образования дибазовых солей, то есть солей, у которых в составе катиона присутствуют два атома металла.
Пример: оксид ртуть(II) (HgO) + серная кислота (H2SO4) = ртуть(II)сульфат (HgSO4)
Одной из особенностей реакции оксидов металлов с H2SO4 является то, что она сопровождается образованием газов. Например, при реакции оксида цинка (ZnO) с серной кислотой образуется газовая продукция — диоксид серы (SO2) и вода (H2O).
Пример: оксид цинка (ZnO) + серная кислота (H2SO4) = диоксид серы (SO2) + вода (H2O) + сульфат цинка (ZnSO4)
Реакция оксидов металлов с H2SO4 также может протекать в разных условиях, в зависимости от концентрации и температуры реагирующих веществ. Например, в условиях высокой концентрации H2SO4 или повышенной температуры может происходить диспропорционирование, то есть одновременное окисление и восстановление металла:
| Реакция: | 4Fe3O4 + 4H2SO4 = 2Fe2(SO4)3 + Fe2O3 + 4H2O |
Таким образом, реакция оксидов металлов с H2SO4 представляет собой важный химический процесс, позволяющий получать соли и сульфаты металлов, а также являющийся источником газовых продуктов. Особенности данной реакции заключаются в образовании дибазовых солей, возможности диспропорционирования и зависимости от условий реакции.
Особенности химической реакции между H2SO4 и оксидами металлов
Химическая реакция между серной кислотой (H2SO4) и оксидами металлов представляет собой образование солей сульфатов металлов и выделение воды.
Серная кислота является одним из самых сильных кислотных оксидов и обладает высокой кислотностью, что позволяет ей образовывать соли с различными основными оксидами металлов.
Химическая реакция между H2SO4 и оксидами металлов происходит с выделением тепла, что свидетельствует о ее экзотермическом характере. При этом осуществляется обмен протонов между серной кислотой и оксидом металла, что приводит к образованию соли сульфата металла и воды.
Применение реакции между H2SO4 и оксидами металлов широко распространено в химической промышленности. Соединения, полученные в результате такой реакции, используются в качестве удобрений, катализаторов, в процессах очистки и обезвреживания отходов, а также в других сферах производства.
Высокая активность H2SO4 и ее реакция с оксидами металлов
Концентрированный серной кислоты (H2SO4) обладает высокой активностью и способностью взаимодействовать с различными веществами, включая оксиды металлов. Такая реактивность обусловлена присутствием двух активных групп гидроксильных (-OH) и сульфогруппы (-SO3H) в молекуле серной кислоты.
Контакт H2SO4 с оксидами металлов приводит к химической реакции, в ходе которой происходит образование соответствующих солей и выделение воды. Реакция может протекать с выделением тепла и газообразных продуктов.
Например, взаимодействие H2SO4 с оксидом железа (Fe2O3) приводит к образованию сернокислого железа (Fe2(SO4)3) и выделению воды:
- Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Также серная кислота может реагировать с другими оксидами металлов, например, с оксидом меди (CuO) и оксидом цинка (ZnO), образуя соответствующие соли:
- CuO + H2SO4 → CuSO4 + H2O
- ZnO + H2SO4 → ZnSO4 + H2O
Такие реакции являются примерами классического окислительно-восстановительного взаимодействия, где оксид металла теряет отрицательные заряды, а H2SO4 выступает в роли окислителя.
Применение H2SO4 в реакциях с оксидами металлов широко используется в химической промышленности для получения различных металлосульфатов, а также в лаборатории и в процессе синтеза органических соединений.
Физико-химические свойства гидроксида серы и его взаимодействие с металлами
Гидроксид серы, также известный как сероватистая кислота или сероватая вода, представляет собой раствор серной кислоты в воде. Его формула H2SO3. Физико-химические свойства этого вещества делают его интересным и широко применимым в различных областях.
Гидроксид серы является безцветной кислой жидкостью с характерным запахом. Он обладает слабыми окислительными свойствами и реагирует с многими металлами, образуя соли серной кислоты. Данная реакция может быть полезной в различных химических процессах.
Взаимодействие гидроксида серы с металлами приводит к образованию солей серной кислоты. Например, гидроксид серы реагирует с железом, в результате чего образуется сульфат железа (II) Гидроксид серы также взаимодействует с некоторыми другими металлами, такими как медь, цинк и марганец, образуя соответствующие соли.
Взаимодействие гидроксида серы с металлами может использоваться в промышленности, например, для получения различных солей серной кислоты. Эти соли могут быть использованы в производстве удобрений, растворителей, пищевых добавок и других химических соединений.
Применение реакции оксидов металлов с H2SO4 в промышленности и научных исследованиях
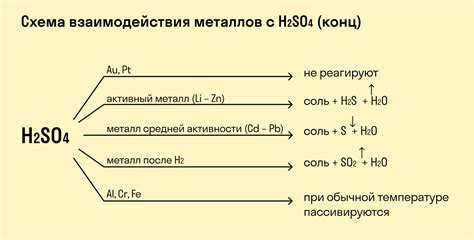
Процесс взаимодействия оксидов металлов с H2SO4 представляет большой интерес для промышленности и научных исследований. Он нашел широкое применение в различных областях, благодаря своим уникальным свойствам.
В промышленности реакция оксидов металлов с H2SO4 используется для производства различных химических соединений. Например, оксиды металлов могут быть использованы в процессе синтеза сульфатов, которые широко применяются в производстве удобрений. Эта реакция также может быть использована для получения металлического соединения, например, цинкового сульфата, который используется в гальванических процессах и в производстве пигментов.
В научных исследованиях реакция оксидов металлов с H2SO4 является одним из методов анализа содержания металлов в исследуемых образцах. Путем проведения данной реакции можно определить концентрацию металла и его присутствие в исследуемом веществе. Это позволяет ученым изучать свойства и химические составы различных материалов и производить качественный и количественный анализ.
Кроме того, реакция оксидов металлов с H2SO4 может быть использована в процессе очистки отходов и сточных вод. Она способна образовывать нерастворимые осадки, которые могут быть отделены и удалены из жидкости. Это позволяет очистить водные ресурсы от загрязнений, вызванных наличием оксидов металлов.
Таким образом, реакция оксидов металлов с H2SO4 имеет широкое применение в различных сферах. Она используется в промышленности для получения различных химических соединений и очистки сточных вод, а также в научных исследованиях для анализа химического состава различных материалов.
Вопрос-ответ
Какую роль играет серная кислота в химической реакции с оксидами металлов?
Серная кислота играет роль окислителя в химической реакции с оксидами металлов. Она отбирает у металлов кислород и превращает его в воду, тем самым превращая оксиды металлов в соли.
Что происходит в результате реакции между серной кислотой и оксидами металлов?
При реакции между серной кислотой и оксидами металлов происходит образование соответствующих солей и воды. Например, оксид железа(III) и серная кислота реагируют, образуя сернокислый железа(III) и воду.
Какие металлы могут реагировать с серной кислотой?
С серной кислотой могут реагировать металлы, обладающие достаточной химической активностью. Например, алюминий, железо, цинк и медь могут реагировать с серной кислотой.
Как можно использовать реакцию между серной кислотой и оксидами металлов в промышленности?
Реакцию между серной кислотой и оксидами металлов можно использовать в промышленности для получения соответствующих солей. Например, сернокислый железа(III) может использоваться в производстве красителей и фармацевтических препаратов.
Как можно использовать реакцию между серной кислотой и оксидами металлов в химическом анализе?
Реакцию между серной кислотой и оксидами металлов можно использовать в химическом анализе для определения наличия и количества определенного металла. Реакция может происходить с образованием нерастворимых веществ, которые потом могут быть проанализированы. Например, реакция между серной кислотой и оксидом меди может использоваться для определения содержания меди в образце.
Может ли реакция между серной кислотой и оксидами металлов протекать без образования солей?
Да, в некоторых случаях реакция между серной кислотой и оксидами металлов может протекать без образования солей. Например, при реакции между серной кислотой и оксидом натрия образуется вода и сернистый ангидрид без образования соли.
