Соли щелочных металлов – это химические соединения, образующиеся при реакции щелочных металлов (лития, натрия, калия, рубидия и цезия) с кислородными или неокисными кислотами. Такие соединения обладают рядом особых свойств и имеют разнообразное применение в различных сферах.
Первое, что стоит отметить, это их химическая активность. Все соли щелочных металлов очень реакционны и хорошо растворимы в воде. Они образуют щелочные растворы, которые обладают щелочными свойствами: они растворяют металлы, образуют с ними ионные соединения и расщепляют кислоты. Благодаря этим свойствам соли щелочных металлов находят широкое применение в химической промышленности, фармацевтической и пищевой отраслях.
Второе важное свойство солей щелочных металлов – их электропроводность. Благодаря наличию ионов в растворах, соли щелочных металлов легко проводят электрический ток. Это свойство используется в электрических батареях и аккумуляторах, а также в процессе электролиза для получения различных металлов и соединений.
Наконец, стоит упомянуть о применении солей щелочных металлов в экологической области. Их использование в процессе очистки сточных вод позволяет эффективно удалять различные загрязнения, в том числе тяжелые металлы. Кроме того, некоторые соли щелочных металлов используются в процессе гидротермальной обработки при производстве стекла и керамики, а также для получения красителей и пигментов.
Свойства солей щелочных металлов

Растворимость. Соли щелочных металлов хорошо растворимы в воде, образуя ионные растворы. Это свойство обусловлено высокой полярностью ионов щелочных металлов и их способностью образовывать водородные связи с водными молекулами. Однако, не все соли щелочных металлов одинаково растворимы в воде. Например, сульфаты и нитраты щелочных металлов хорошо растворимы, в то время как карбонаты и фосфаты имеют ограниченную растворимость.
Электропроводность. Ионные растворы солей щелочных металлов обладают высокой электропроводностью. Это связано со способностью ионов щелочных металлов передвигаться в растворе и принимать участие в проводимости электрического заряда. Электропроводность ионных растворов солей щелочных металлов является одним из ключевых свойств, влияющих на их применение в различных электротехнических устройствах.
Температурная стабильность. Соли щелочных металлов обладают высокой температурной стабильностью. Они обычно сохраняют свою структуру и свойства при повышенных температурах. Это позволяет использовать соли щелочных металлов в высокотемпературных процессах, таких как производство стекла, керамики и металлов.
Щелочные свойства. Соли щелочных металлов обладают щелочными свойствами, что означает, что они образуют щелочные растворы в воде. Это связано с высокими значениями pH и высокой концентрацией гидроксидных ионов в растворе. Щелочные растворы солей щелочных металлов находят широкое применение в различных промышленных процессах, а также в бытовых целях.
Реакция с кислотами. Соли щелочных металлов реагируют с кислотами, образуя соли кислот. Эта реакция основа для процессов нейтрализации, которые широко используются в химической промышленности для получения различных соединений.
Физические свойства солей щелочных металлов
Растворимость: Соли щелочных металлов обладают высокой растворимостью в воде. Они легко и быстро растворяются, образуя прозрачные растворы.
Температурные свойства: Соли щелочных металлов обычно имеют высокую точку плавления и кипения. К примеру, точка плавления хлорида натрия составляет около 801°C, а точка кипения около 1413°C.
Электропроводность: Соли щелочных металлов являются электролитами, то есть они могут проводить электрический ток в расплавленном состоянии или в растворе. Это свойство обусловлено наличием ионов в растворе, которые образуют заряды и обеспечивают передачу электричества.
Цвет: Соли щелочных металлов обычно обладают яркими цветами. Например, хлорид лития имеет красно-фиолетовый цвет, а хлорид калия - фиолетово-синий.
Плотность: Соли щелочных металлов обладают высокой плотностью. Например, плотность хлорида натрия составляет около 2,16 г/см³.
Твердость: Соли щелочных металлов обычно являются твердыми веществами, хотя некоторые также могут быть мягкими или трудносжимаемыми веществами.
Реакция с кислотами: Соли щелочных металлов реагируют с кислотами, образуя соли и воду. Эта реакция называется нейтрализационной реакцией.
Химические свойства солей щелочных металлов
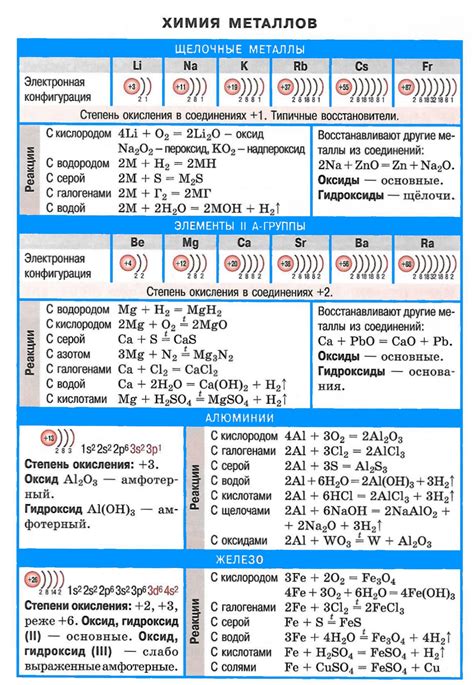
Соли щелочных металлов являются соединениями, образованными отрицательными иоными радикалами с положительно заряженными ионами щелочных металлов. Они обладают рядом химических свойств, которые определяют их широкое применение в различных отраслях промышленности.
Растворимость: Соли щелочных металлов обладают высокой растворимостью в воде, что делает их удобными для использования в различных процессах. Некоторые из них, такие как хлорид натрия (NaCl) и сульфат натрия (Na2SO4), являются сильными электролитами и могут полностью диссоциировать в растворе.
Кристаллическая структура: Соли щелочных металлов образуют кристаллическую решетку, которая имеет особенности в зависимости от конкретного соединения. Например, хлорид натрия образует кубическую решетку, а карбонат натрия (Na2CO3) имеет трехслойную строение. Такая разнообразная кристаллическая структура солей щелочных металлов является одной из причин их разнообразных свойств и применения.
Щелочной характер: Соли щелочных металлов обладают выраженным щелочным характером, что проявляется в их основных свойствах. Они образуют гидроксиды, которые в растворе обладают высоким рН и широко применяются в процессах нейтрализации и регулирования кислотно-щелочного баланса.
Применение: Соли щелочных металлов находят широкое применение в различных отраслях промышленности. Например, хлорид натрия применяется в процессах обезвоживания и консервирования пищевых продуктов, сульфат натрия используется в производстве стекла и мыла, карбонат натрия применяется в процессах очистки воды и производстве стекла. Также соли щелочных металлов используются в фармацевтической промышленности, электротехнике и других отраслях.
Применение солей щелочных металлов
Соли щелочных металлов, таких как натрий, калий и литий, имеют широкое применение в различных отраслях промышленности и научных исследованиях.
Одно из основных применений солей щелочных металлов - это производство щелочей. Щелочи, такие как гидроксид натрия и гидроксид калия, широко используются в химической промышленности для производства мыла, стекла, бумаги и других продуктов. Они также являются важными компонентами в производстве моющих средств, дезинфицирующих средств и многое другое.
Соли щелочных металлов также применяются в производстве огнеупорных материалов. Например, нитраты натрия и калия используются при производстве керамики, огнеупорного стекла и огнеупорного бетона. Эти материалы обладают высокими температурными стойкостями и широко используются в промышленности, где требуется высокая устойчивость к нагреву.
Кроме того, соли щелочных металлов используются в производстве технических реагентов. Например, перхлораты калия и лития используются в ракетной промышленности для создания взрывателей и устойчивых твердотопливных смесей. Они также находят применение в батареях и аккумуляторах благодаря своей способности хранить энергию.
Применение солей щелочных металлов также распространено в медицине. Некоторые соли, например, цитраты, используются в качестве противозачаточных средств, облегчая процесс регуляции кислотности в организме. Кроме того, соли лития широко используются в психиатрической практике для лечения некоторых психических расстройств, таких как биполярное расстройство и маниакально-депрессивное психозное состояние.
Соли щелочных металлов в промышленности

Соли щелочных металлов имеют широкое применение в промышленности благодаря своим особым свойствам и химическим связям. Они используются в различных процессах, таких как производство стекла, мыла и щелочных батарей. Щелочные металлы, такие как натрий и калий, находят применение во многих отраслях промышленности.
Натрий является одним из основных ингредиентов стекла. Соли натрия добавляются для повышения термической стабильности и прозрачности стекла. Они также используются в производстве мыла, где натрий гидроксид служит основным компонентом. Эти соли обладают моющими свойствами и облегчают удаление грязи и жировых отложений.
Калий, в свою очередь, широко применяется в щелочных батареях. Использование солей калия в батареях позволяет получить высокую производительность и длительное время работы. Калий также используется в процессе глицинатации, который является важным шагом в производстве некоторых лекарственных препаратов.
Однако, несмотря на полезные свойства солей щелочных металлов, их использование требует осторожности и соблюдения мер предосторожности. Щелочные вещества могут быть едкими и опасными при неправильном использовании. При работе с солями щелочных металлов необходимо соблюдать правила безопасности и использовать защитное оборудование.
Соли щелочных металлов в медицине
Соли щелочных металлов, такие как натрий, калий и литий, широко применяются в медицине благодаря своим полезным свойствам и эффективности в лечении различных заболеваний.
Одним из основных применений солей щелочных металлов в медицине является их использование в реабилитационной терапии. Эти соли часто применяются для восстановления водно-электролитного баланса организма, особенно в случаях дегидратации или после интенсивных физических нагрузок. Они помогают устранить дефицит электролитов, таких как натрий и калий, что способствует нормализации работы органов и систем.
Кроме того, соли щелочных металлов широко используются в лечении сердечно-сосудистых заболеваний. Калий, например, является важным элементом для нормального функционирования сердечной мышцы. При недостатке калия могут возникать нарушения ритма сердца и другие сердечные проблемы. Поэтому применение калия в виде солей щелочных металлов может помочь восстановить сбалансированное сердечное ритм.
Соли щелочных металлов также используются в качестве противосудорожных средств. Литий, например, эффективно применяется для лечения эпилепсии, биполярного аффективного расстройства и других психических заболеваний. Он помогает стабилизировать настроение, уменьшить частоту и интенсивность судорожных приступов, а также улучшить психическое самочувствие пациента.
В целом, соли щелочных металлов играют значительную роль в медицине и являются неотъемлемой частью многих лекарственных препаратов. Их применение в различных областях медицины обеспечивает эффективное лечение и благоприятное влияние на организм пациента.
Соли щелочных металлов в быту

Соли щелочных металлов в быту имеют широкое применение благодаря своим особым свойствам. Натриевые соли, например, используются в кулинарии для усиления вкуса и консервации пищевых продуктов. Калиевые соли применяются в качестве удобрений для растений, благодаря своему содержанию питательных веществ.
Соли щелочных металлов также используются в бытовой химии. Натриевый карбонат (сода) применяется для мытья и чистки поверхностей, поскольку обладает отличными моющими свойствами. Калий гидроксид (поташ) применяется в производстве мыла и стиральных порошков.
Благодаря своей высокой химической активности, соли щелочных металлов применяются также в производстве различных химических соединений и материалов. Например, хлорид натрия используется для производства хлора и щелочи, а карбонат калия применяется в производстве стекла.
Кроме того, соли щелочных металлов находят применение в медицине. Некоторые натриевые и калиевые соли используются в лекарственных препаратах для поддержания баланса электролитов в организме.
Вопрос-ответ
Какие свойства имеют соли щелочных металлов?
Соли щелочных металлов обладают рядом характерных свойств. Во-первых, они обычно являются белыми кристаллическими веществами. Во-вторых, они растворяются в воде, образуя ионно-молекулярные растворы. Кроме того, они обладают высокой плотностью и температурой плавления. Их растворы обладают щелочной реакцией и способны взаимодействовать с кислотами. Они также демонстрируют хорошую проводимость электрического тока в растворах и в расплавленном состоянии.
Какие вещества являются щелочными металлами?
Щелочные металлы включают следующие элементы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все эти элементы относятся к первой группе периодической системы элементов и обладают сходными химическими свойствами. Они являются мягкими металлами, хорошо проводящими тепло и электричество.
Какие применения имеют соли щелочных металлов?
Соли щелочных металлов имеют широкий спектр применений в различных отраслях промышленности и науки. Например, натриевая соль (поваренная соль) используется в пищевой промышленности, калиевые соли применяются в сельском хозяйстве в качестве удобрений, а также в производстве стекла и мыла. Литиевые соли используются в литий-ионных аккумуляторах и в фармацевтической промышленности. Рубидий и цезий применяются в исследованиях в области физики и химии.
Каковы основные свойства солей щелочных металлов?
Основные свойства солей щелочных металлов включают высокую плотность, температуру плавления и кипения, а также растворимость в воде. Они обладают щелочной реакцией, то есть при взаимодействии с кислотами образуют соль и воду. Растворы солей щелочных металлов обычно обладают высокой электропроводностью из-за наличия ионов. Они также могут образовывать кристаллы различных форм и структур.

