В химическом курсе 9 класса особое внимание уделяется изучению соединений щелочных металлов с оксидами. Эти соединения представляют собой важные химические вещества и имеют широкое применение в различных отраслях промышленности, медицине и научных исследованиях.
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и рубидий (Rb), обладают высокой реакционной активностью. Они легко вступают в химические реакции с кислородом (O) и образуют щелочные оксиды, которые обладают особыми свойствами.
Соединение щелочных металлов с оксидами происходит путем образования ионных связей. Щелочные металлы отдают электроны, становясь положительно заряженными ионами, а кислород принимает эти электроны, образуя отрицательно заряженные оксидные ионы. В результате образуется кристаллическая решетка, в которой ионы щелочного металла и оксида расположены в определенном порядке.
Таблица 9 класса, представленная ниже, показывает соединение щелочных металлов с оксидами и основные свойства этих соединений:
Оксид - щелочный металл
Li2O - литий
Na2O - натрий
K2O - калий
Rb2O - рубидий
Соединения щелочных металлов с оксидами обладают высокой щелочностью и могут использоваться в процессе нейтрализации кислот. Они также используются в качестве сырья для получения различных соединений, например, в производстве стекла, керамики и щелочей. Кроме того, эти соединения имеют большую важность в области медицины, где применяются в качестве лекарственных препаратов и добавок к пище.
Соединение щелочных металлов с оксидами
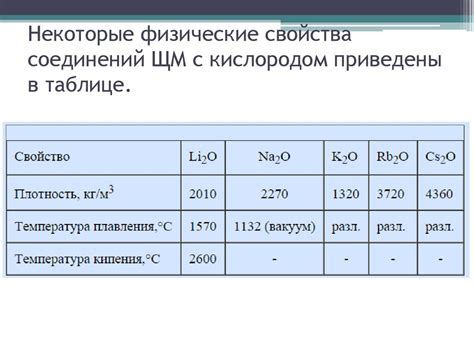
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), образуют соединения с оксидами, включая оксиды лития (Li2O), оксид натрия (Na2O), оксид калия (K2O), оксид рубидия (Rb2O) и оксид цезия (Cs2O). Эти соединения обладают важными свойствами и находят широкое применение в различных областях.
Щелочные металлы являются металлическими элементами, характеризующимися низкой плотностью, низкой температурой плавления и высокой реактивностью. Они активно взаимодействуют с оксидами, образуя ионные соединения. Эти соединения могут быть использованы в процессах производства стекла, керамики, щелочных растворов и других продуктов.
Соединения щелочных металлов с оксидами обладают хорошей электропроводностью и термической стабильностью, их можно использовать в качестве электролитов в различных электрохимических процессах. Они также используются в качестве катализаторов при синтезе органических веществ и в других химических реакциях.
Соединения щелочных металлов с оксидами обладают различными физическими и химическими свойствами, которые зависят от типа щелочного металла и его соединения с оксидом. Например, оксид лития обладает высокой растворимостью в воде и используется в батареях и аккумуляторах, а оксид натрия используется в производстве стекла и керамики.
В итоге, соединение щелочных металлов с оксидами является важным аспектом в химии и находит широкое применение в различных областях. Эти соединения обладают уникальными свойствами, которые делают их полезными в различных процессах и продуктах.
Оксиды щелочных металлов
Оксиды щелочных металлов — это соединения, образующиеся при реакции щелочных металлов с кислородом. В таблице ниже приведены некоторые оксиды щелочных металлов, их формулы и свойства:
| Щелочный металл | Оксид | Формула | Свойства |
|---|---|---|---|
| Литий | Оксид лития | Li2O | Белый кристаллический порошок, растворяется в воде, образуя щелочную среду |
| Натрий | Оксид натрия | Na2O | Белый кристаллический порошок, растворяется в воде, образуя щелочную среду |
| Калий | Оксид калия | K2O | Белый кристаллический порошок, растворяется в воде, образуя щелочную среду |
Оксиды щелочных металлов играют важную роль в различных отраслях промышленности. Например, оксид натрия и оксид калия широко используются в стекольной промышленности для придания прозрачности и прочности стеклу. Они также применяются в производстве мыла, моющих средств и различных химических соединений.
Оксиды щелочных металлов обладают высокой щелочностью, что связано с их способностью реагировать с водой и образовывать гидроксиды. Эта реакция основания с водой называется гидратацией. Гидроксиды щелочных металлов являются сильными основаниями и используются в различных областях, например, в железнодорожной отрасли для очистки рельсов.
Свойства соединений
Соединения щелочных металлов с оксидами обладают рядом характерных свойств, которые являются результатом их строения и химической реакционной способности.
1. Физические свойства:
- Соединения щелочных металлов с оксидами обычно являются твердыми кристаллическими веществами.
- Они обладают высокой температурой плавления и кипения.
- Многие из этих соединений обладают хорошей растворимостью в воде и образуют щелочные растворы.
2. Химические свойства:
- Соединения щелочных металлов с оксидами реагируют с водой, образуя гидроксиды щелочных металлов.
- Они также могут реагировать с кислородом, диоксидом углерода и другими оксидами, образуя соли.
- Многие из этих соединений обладают щелочными свойствами, то есть они реагируют со средами, обладающими кислотными свойствами.
3. Применение:
- Щелочными металлами и их соединениями с оксидами широко пользуются в промышленности, медицине, сельском хозяйстве и других областях.
- Например, гидроксид натрия (щелочь) используется в производстве мыла, стекла, бумаги и других продуктов.
- Они также широко применяются в качестве катализаторов, светофильтров, реагентов и т.д.
Примеры соединений
Щелочные металлы - натрий, калий, рубидий и цезий - обладают химической активностью, что позволяет им образовывать различные соединения с оксидами.
Примером соединения щелочного металла с оксидом является образование натрия оксида (Na2O) или калия оксида (K2O). Эти соединения имеют сильно щелочной характер и используются в различных процессах, таких как производство стекла или щелок.
Другим примером является образование карбоната щелочного металла, например карбоната натрия (Na2CO3) или карбоната калия (K2CO3). Эти соединения используются в производстве мыла, стекла и щелочи.
Также, щелочные металлы могут образовывать нитраты, например нитрат натрия (NaNO3) или нитрат калия (KNO3). Эти соединения используются в сельском хозяйстве как удобрения и в производстве взрывчатых веществ.
В таблице представлены некоторые примеры соединений щелочных металлов с оксидами:
| Щелочный металл | Оксид | Пример соединения |
|---|---|---|
| Натрий | Оксид | Na2O - натрий оксид |
| Калий | Оксид | K2O - калий оксид |
| Рубидий | Оксид | Rb2O - рубидий оксид |
| Цезий | Оксид | Cs2O - цезий оксид |
Это только некоторые примеры соединений щелочных металлов с оксидами. Всего их существует гораздо больше и они используются в различных областях химии, техники и промышленности.
Применение в практике

Соединения щелочных металлов с оксидами широко применяются в различных областях практики. Одно из основных применений – это производство жидкого стекла. Щелочные металлы, такие как натрий и калий, в сочетании с оксидами кремния и бора образуют основу для стекла.
В процессе плавления смеси оксидов и металлов, образуется стекловидный материал, который после остывания и закаливания приобретает прочность и прозрачность. Такое стекло применяется в производстве оконных стекол, посуды, флаконов и т.д.
Щелочные металлы с оксидами также используются в качестве активных компонентов в электролитах для элементов топливных ячеек. Такие электролиты обладают высокой проводимостью и стабильностью, что позволяет эффективно преобразовывать химическую энергию в электрическую. Электролит состоит из смеси оксидов и щелочного металла, которые образуют ионные каналы для передачи заряда через элемент топливной ячейки.
Кроме того, соединения щелочных металлов с оксидами применяются в качестве катализаторов при различных химических реакциях. Например, оксиды натрия и калия могут использоваться при каталитическом крекинге нефти, чтобы увеличить выход бензина и других легких фракций. Такие катализаторы обладают высокой активностью и стабильностью, что позволяет повысить эффективность процесса и снизить затраты на энергию и сырье.
Вопрос-ответ
Какие металлы соединяются с оксидами?
Металлы группы 1 (щелочные металлы) соединяются с оксидами.
Какие оксиды образуются при реакции щелочных металлов с оксидами?
При реакции щелочных металлов с оксидами образуются основные оксиды, такие как оксид лития (Li2O), оксид натрия (Na2O), оксид калия (K2O) и т.д.
Какие соединения образуются при реакции металлов группы 1 с оксидами?
При реакции металлов группы 1 с оксидами образуются соли и вода. Например, реакция лития (Li) с оксидом водорода (H2O) приводит к образованию лития гидроксида (LiOH) и выделению водорода (H2).
Что происходит при реакции щелочных металлов с оксидами?
При реакции щелочных металлов с оксидами происходит образование основных оксидов и соединений, таких как соли и вода.
Какие свойства имеют основные оксиды, образующиеся при реакции щелочных металлов с оксидами?
Основные оксиды, образующиеся при реакции щелочных металлов с оксидами, обладают выраженными щелочными свойствами. Они растворяются в воде, образуя гидроксиды, и могут вызывать щелочную реакцию.
