Щелочные металлы образуют первую группу периодической таблицы и включают в себя лихий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Они отличаются особыми свойствами и являются одними из самых активных элементов в химии. Распределение электронов в атомах щелочных металлов играет важную роль в определении их химических и физических свойств.
Атомы щелочных металлов имеют простую электронную конфигурацию, которая соответствует их группе в периодической таблице. Например, натрий имеет 11 электронов, распределенных на энергетические уровни следующим образом: 2, 8, 1. Первые два электрона находятся на внутреннем энергетическом уровне, следующие восемь электронов находятся на втором энергетическом уровне, и последний электрон расположен на третьем, наиболее внешнем уровне энергии.
Распределение электронов в атомах щелочных металлов связано с их химической активностью. У атомов щелочных металлов наиболее внешний электрон находится на достаточно большом расстоянии от положительно заряженного ядра, что делает его легко доступным для взаимодействия с другими атомами. Поэтому щелочные металлы легко образуют ионы с положительным зарядом, отдавая свой внешний электрон при реакции с другими веществами.
Распределение электронов в атомах

Распределение электронов в атомах является важной характеристикой, определяющей химические свойства элементов. Каждый атом может содержать определенное количество электронов, которые орбитализируют вокруг ядра.
В основном электронная оболочка атома состоит из нескольких энергетических уровней, на которых располагаются электроны. Каждый энергетический уровень может вместить определенное количество электронов, рассчитываемое по формуле 2n^2, где n - номер энергетического уровня. Например, первый уровень может содержать максимум 2 электрона (2*1^2 = 2), второй уровень - 8 электронов (2*2^2 = 8).
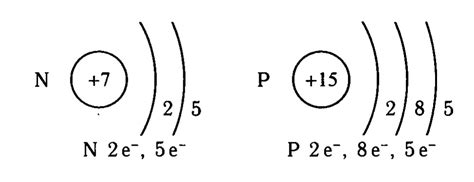
Распределение электронов в атоме происходит в соответствии с принципом электронной конфигурации. Согласно этому принципу, электроны заполняют энергетические уровни, начиная с самого низкого. Так, на первом уровне размещаются 2 электрона, на втором - 8 электронов, на третьем - 18 электронов, и т.д. Однако, на практике, при заполнении энергетических уровней есть некоторые исключения и особенности.
В атомах щелочных металлов, таких как литий, натрий, калий и др., распределение электронов может быть описано следующим образом. Все щелочные металлы имеют внешнюю электронную оболочку s-типа, которая содержит один электрон на последнем энергетическом уровне. Другими словами, они имеют одного электрон на s-орбитали. Это делает щелочные металлы очень активными элементами, готовыми образовывать ионные связи и легко отдавать свой внешний электрон другим атомам.
Щелочные металлы
Щелочные металлы - это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают рядом химических и физических свойств, которые делают их уникальными.
Распределение электронов в атомах щелочных металлов можно описать с помощью электронной конфигурации. У каждого щелочного металла внешним энергетическим уровнем является s-подуровень, на котором находится один электрон. Это делает их очень реакционноспособными, так как они готовы легко отдавать этот электрон.
Щелочные металлы хорошо ионизируются, то есть они легко теряют свой внешний электрон и образуют положительные ионы с единичным зарядом. Это свойство делает их отличными реагентами в реакциях с другими веществами.
Кроме того, щелочные металлы имеют низкую плотность и низкую температуру плавления, что делает их мягкими и легкими для обработки. Они также обладают высокой теплопроводностью и электрической проводимостью, что делает их полезными в различных технологических приложениях, таких как производство батарей и электрических проводов.
Особенности распределения электронов
Щелочные металлы представляют собой группу элементов периодической таблицы, которые характеризуются своими особыми свойствами и структурой электронной оболочки. Одной из важных особенностей щелочных металлов является их электронная конфигурация, которая включает в себя распределение электронов в атоме.
Распределение электронов в атомах щелочных металлов происходит по определенным правилам и принципам. Основной принцип, определяющий распределение электронов, это принцип заполнения электронных оболочек по возрастающей энергии. Суть этого принципа заключается в том, что электроны заполняют энергетические уровни от более низкой к более высокой энергии.
Кроме того, важным аспектом распределения электронов в атомах щелочных металлов является наличие внешней s-подобной электронной оболочки. Именно эта оболочка содержит все валентные электроны, которые обладают наибольшей энергией и принимают участие в химических реакциях. Внешние s-электроны определяют химические свойства щелочных металлов и их склонность к образованию ионов.
Чаще всего распределение электронов в атомах щелочных металлов можно представить в виде таблиц, где каждый столбец соответствует электронной оболочке, а каждая строка - электронному подуровню. Такая таблица наглядно показывает распределение электронов по оболочкам и подуровням и помогает лучше понять структуру атома.
Влияние на свойства щелочных металлов
Щелочные металлы, такие как литий, натрий и калий, обладают рядом уникальных свойств, которые определяются распределением их электронов в атомах.
Одним из важных свойств щелочных металлов является их низкое плавление и кипение. Это объясняется наличием одного электрона в валентной оболочке атома щелочного металла. Такой электрон легко и свободно двигается вокруг атома, что делает металлы мягкими и хорошими проводниками электричества и тепла.
Еще одним важным свойством щелочных металлов является их высокая реактивность. Это связано с тем, что у атомов щелочных металлов самый слабый уровень энергии связи с электронами. Из-за этого, они легко отделяются от атома, образуя положительные ионы. Такие ионы обладают большой подвижностью и способностью образовывать стабильные соединения с другими элементами.
Благодаря высокой реактивности и проводимости, щелочные металлы широко используются в различных областях: от изготовления батарей и сплавов до производства стекла и чистки реакторов. Они также используются в химии для проведения различных химических реакций и синтеза соединений.
В целом, электронное строение и распределение электронов в атомах щелочных металлов является основной причиной их уникальных свойств. Это делает их важными и неотъемлемыми компонентами в различных областях науки и техники.
Вопрос-ответ
Что такое распределение электронов в атомах щелочных металлов?
Распределение электронов в атомах щелочных металлов определяет, как электроны расположены вокруг ядра атома. Это включает в себя информацию о том, сколько электронов находится в каждой энергетической оболочке и как эти электроны заполняют подоболочки с разными значениями момента.
Какое количество электронов у щелочных металлов?
Ущелочных металлов в атоме обычно находится один электрон в внешней энергетической оболочке, но есть одно исключение: в гелии идеально укомплектованным числом электронов будет два, по одному на каждую его электронную оболочку.
Какие энергетические уровни имеются у щелочных металлов?
У щелочных металлов есть одна внешняя энергетическая оболочка, называемая s-оболочкой. В этой оболочке есть одна s-подоболочка, которая может вместить максимум 2 электрона. Остальные энергетические оболочки внутри атома, называемые внутренними энергетическими оболочками, заполнены электронами соответствующим образом в соответствии с принципом заполнения.
Какую роль играет распределение электронов в атомах щелочных металлов в химических свойствах?
Распределение электронов в атомах щелочных металлов влияет на их химические свойства. Наличие одного электрона во внешней энергетической оболочке делает их более активными в химических реакциях, так как они стремятся отдать этот электрон. Это делает щелочные металлы очень реактивными и хорошими ионными агентами.
