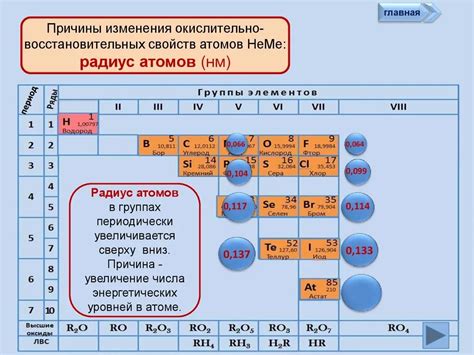
Радиус атома - одна из основных характеристик химического элемента, определяющая его размер по принципу наиболее удаленной от ядра электронной оболочки. Размер атомов может сильно варьироваться в зависимости от типа элемента и его места в периодической системе. Металлы и неметаллы - основные классы элементов, имеющие существенные различия в радиусах своих атомов.
Вообще говоря, атомы металлов обычно имеют больший радиус, чем атомы неметаллов. Это связано с особенностью строения и шириной электронных оболочек у атомов данных классов.
Металлы в периодической системе принято располагать слева от линии "ступеньки", называемой чертой металлов. Металлические элементы характеризуются большими атомными радиусами, так как у них нарушается заполнение последовательного ряда энергетических уровней электронами. Большая ширина электронного облака приводит к увеличению размеров атомов.
В отличие от металлов, неметаллы располагаются справа от черты металлов и обычно имеют меньший радиус атомов. Это может быть связано со строением и энергетическим состоянием электронных оболочек данных элементов. К примеру, неметаллические атомы, такие как кислород или фтор, обладают более плотными электронными оболочками, что делает их атомы более маленькими по размеру.
Сравнение радиусов атомов металлов и неметаллов позволяет обнаружить их основные различия и подтверждает их различное место в периодической системе. Эти различия имеют важное значение для понимания химического поведения элементов и их реакционной способности.
Сравнение радиуса атомов металлов и неметаллов: ключевые различия
Одной из основных характеристик атома, определяющей его размер, является радиус атома. Радиус атомов металлов и неметаллов отличается значительно и определяется множеством факторов, включая их электронную структуру и физические свойства.
Ключевое различие между радиусом атомов металлов и неметаллов заключается в их внешней электронной оболочке. У металлов внешняя электронная оболочка состоит из малого количества электронов, что обуславливает больший радиус атома. В то время как у неметаллов внешняя электронная оболочка содержит много электронов, что ведет к уменьшению размера атома.
Важным фактором, влияющим на радиус атомов металлов и неметаллов, является заряд ядра атома. У металлов заряд ядра чаще всего небольшой, что позволяет электронам находиться на большом расстоянии от ядра и, следовательно, увеличивает радиус атома. У неметаллов заряд ядра обычно большой, что притягивает электроны ближе к ядру и сужает радиус атома.
Другим важным фактором, влияющим на радиус атомов металлов и неметаллов, является силы притяжения электронов друг к другу. У металлов электроны между собой слабо притягиваются, что позволяет им занимать большую область и увеличивает радиус атома. У неметаллов электроны сильно притягиваются друг к другу, что делает радиус атома меньше.
- Однако следует отметить, что радиус атома может изменяться в зависимости от основания. Например, радиус атома может уменьшаться по периоду и увеличиваться по группе.
- Также стоит отметить, что сравнение радиусов атомов металлов и неметаллов имеет важное значение для понимания их химических свойств, включая способность образовывать химические связи и реагировать с другими веществами.
В целом, радиус атомов металлов и неметаллов имеет существенные различия, которые определяют их химическую активность и взаимодействие с окружающей средой. Понимание этих различий помогает углубить знания о строении и свойствах элементов Периодической системы.
Размеры вещественных частиц
Вещественные частицы – это атомы, ионы или молекулы, которые образуют вещество. Размеры вещественных частиц являются важными параметрами, которые влияют на свойства веществ и их взаимодействие.
Радиус атомов и ионов – одна из характеристик размера вещественных частиц. Размер атомов металлов исчисляется в ангстремах (Å), когда размер атомов неметаллов принято измерять в пикометрах (pm). Он определяется расстоянием от ядра атома до границы его электронной оболочки.
Радиус атома металла обычно меньше радиуса атома неметалла. Это связано с тем, что у атомов металлов больше число электронов на внешней электронной оболочке, что приводит к сильной электростатической притяжению электронов и ядра атома. В результате, электроны металла более плотно располагаются около ядра, сжимая его размер.
Размер молекул также может быть определен исходя из радиуса атомов, из которых они образованы. Например, молекула воды состоит из двух атомов водорода и одного атома кислорода. Сумма радиусов атомов водорода и кислорода определяет размер молекулы воды.
Размеры вещественных частиц имеют важное значение в различных областях науки и технологий, включая химию, физику, биологию и материаловедение. Изучение и понимание размеров вещественных частиц позволяет предсказывать и объяснять их свойства и поведение.
Влияние электронной структуры
Электронная структура является одним из ключевых факторов, влияющих на радиус атомов металлов и неметаллов. Различия в электронной структуре данных элементов приводят к существенным различиям в их размерах.
У металлов электронная структура характеризуется наличием малого количества электронов на внешней энергетической оболочке и большим количеством электронов на внутренних оболочках. Это приводит к тому, что металлы обладают малыми радиусами атомов. Неон и гелий являются исключением среди металлов, так как у них на внешней оболочке находятся полностью заполненные s- и p-подуровни, что приводит к увеличению их радиусов.
У неметаллов электронная структура характеризуется наличием большого количества электронов на внешней энергетической оболочке. Неметаллы стараются заполнить внешние энергетические оболочки электронами, чтобы достичь стабильной конфигурации. В результате, атомы неметаллов имеют больший радиус по сравнению с атомами металлов. Кроме того, атомы неметаллов имеют чётко выраженные границы, так как за пределами внешней энергетической оболочки отсутствуют электроны.
Таким образом, электронная структура является определяющим фактором в различии радиусов атомов металлов и неметаллов. Металлы, обладающие малыми радиусами атомов, имеют меньшее количество электронов на внешней энергетической оболочке, в то время как неметаллы, обладающие большими радиусами, имеют большее количество электронов на внешней оболочке.
Условия образования химических связей
Химические связи формируются между атомами вещества и определяют его химические и физические свойства. Они возникают под влиянием различных факторов, включая электронное строение атомов и их энергетические состояния.
В основе образования химических связей лежат электростатические взаимодействия между зарядами электронов и ядер атомов. Наиболее распространенными видами химических связей являются ионная, ковалентная и металлическая связи.
Ионная связь образуется между атомами с разными электроотрицательностями, что приводит к образованию ионов с положительным и отрицательным зарядами. Эти ионы притягиваются друг к другу электростатическими силами и образуют кристаллическую решетку.
Ковалентная связь возникает между атомами, когда они обменивают пары электронов. В результате образуется молекула, где электроотрицательные атомы связаны совместно используемыми электронными парами. Ковалентная связь может быть полярной или неполярной в зависимости от разности электроотрицательности атомов.
Металлическая связь характерна для металлов. Она обусловлена наличием общих электронов, которые свободно передвигаются между положительно заряженными ионами металла. Это создает силы притяжения, обеспечивающие хорошую проводимость электричества и тепла у металлов.
Взаимодействие с другими элементами

Взаимодействие атомов металлов и неметаллов с другими элементами может быть совершенно различным из-за их различной химической природы.
Металлы обычно образуют ионные соединения с неметаллами, теряя электроны и образуя положительные ионы. Они обладают свойствами хороших проводников электричества и тепла, а также могут образовывать сплавы и растворы с другими металлами.
Неметаллы могут образовывать как ионные, так и ковалентные соединения с другими элементами. Они обычно получают электроны и образуют отрицательные ионы. Многие неметаллы обладают высокой электроотрицательностью и способны образовывать ковалентные связи с другими неметаллами.
Взаимодействие металлов и неметаллов может приводить к образованию разнообразных соединений, таких как оксиды, хлориды, сульфиды и т.д. Эти соединения могут иметь различные физические и химические свойства и находить применение в различных областях, таких как металлургия, электроника и сельское хозяйство.
Вопрос-ответ
Какова основная разница между радиусом атомов металлов и неметаллов?
Основная разница заключается в том, что у металлов радиус атома обычно больше, чем у неметаллов. Это связано с электронной структурой атомов и способом образования химических связей.
Какие факторы влияют на радиус атома металла?
На радиус атома металла влияют такие факторы, как количество электронных оболочек и заряд ядра. Чем больше электронных оболочек у атома металла и меньше заряд ядра, тем больше радиус атома.
Почему радиус атома металла обычно больше, чем у неметалла?
Радиус атома металла обычно больше, чем у неметалла, потому что металлы имеют более слабо привязанные электроны на внешней энергетической оболочке, что делает радиус атома металла больше.
Можно ли сказать, что радиус атомов металлов примерно одинаковый?
Нет, нельзя однозначно сказать, что радиус атомов металлов примерно одинаковый. Радиус атома может различаться в зависимости от типа металла и его положения в периодической системе.
В чем заключается значение радиуса атома для химических свойств металлов?
Значение радиуса атома влияет на химические свойства металла, так как радиус атома определяет его способность формировать связи с другими атомами и участвовать в химических реакциях.
Как можно сравнить радиусы атомов металлов и неметаллов?
Радиусы атомов металлов и неметаллов можно сравнить, рассматривая данные периодической системы элементов. Обычно радиус атома металла больше, чем у неметалла, но есть и исключения.
Можно ли сказать, что радиус атома металла имеет прямую зависимость от его массы?
Нет, радиус атома металла не имеет прямой зависимости от его массы. Радиус атома металла определяется электронной структурой атома и зарядом его ядра, а не его массой.
