Электронная конфигурация атомов элементов определяет их свойства, включая возможность образования ионов. По установленным правилам, ионы двухвалентных металлов обычно имеют электронную конфигурацию 1s2 2s2 2p6, где число электронов в последней энергетической оболочке равно 2.
Однако, вопрос возникает: возможно ли существование ионов двухвалентных металлов, у которых в последней энергетической оболочке присутствует один внешний s-электрон, имеющий электронную конфигурацию 1s2 2s2 2p6 3s1?
Ответ на этот вопрос нетривиален. Во-первых, в соответствии с принципом заполнения энергетических уровней, электроны сначала заполняют низшие уровни, а затем переходят на более высокие. Поэтому, электронная конфигурация 1s2 2s2 2p6 3s1 нарушает этот принцип, так как должна быть заполнена последняя субоболочка s перед переходом на следующую субоболочку.
Однако, в ряде исключительных случаев, при наличии внешних факторов, таких как высокое давление или высокая температура, металлы могут образовывать необычные ионы с отклонениями от типичной электронной конфигурации. Такие ионы называются металлидами. Возможно, в условиях экстремального давления ион двухвалентного металла с электронной конфигурацией 1s2 2s2 2p6 3s1 может существовать в виде металлида и иметь особые свойства.
Ионы двухвалентных металлов: реальность электронной конфигурации 1s2 2s2 2p6 3s1?
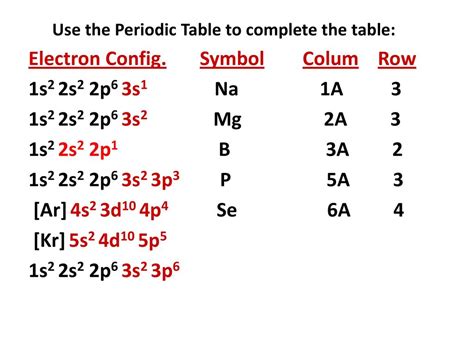
Электронная конфигурация 1s2 2s2 2p6 3s1 относится к атому неподвижного натрия (Na) в его основном состоянии. В то же время, ионы двухвалентных металлов, таких как барий (Ba2+), стронций (Sr2+) и кальций (Ca2+), имеют некоторые общие особенности своей электронной структуры.
Образование ионов двухвалентных металлов возникает путем потери двух электронов из внешнего энергетического уровня. Для них характерно наличие полностью заполненного n-1 энергетического уровня и незаполненного n-го энергетического уровня. Например, ион кальция имеет электронную конфигурацию [Ar] 4s0, что обозначает потерю двух электронов из 4s-подуровня.
Следовательно, электронная конфигурация 1s2 2s2 2p6 3s1 является типичной для атомов неподвижного натрия, но не может быть применима к ионам двухвалентных металлов. Она отражает только электронную структуру атома натрия в основном состоянии и не описывает ионы, которые образуются путем потери или приобретения электронов.
История исследования электронной конфигурации двухвалентных металлов
Электронная конфигурация двухвалентных металлов связана с их химическими свойствами и способностью образовывать ионы с двойным положительным зарядом. Этот вопрос начал активно исследоваться в XIX веке, когда ученые обнаружили связь между электронной структурой атомов и их химическими свойствами.
Одним из первых ученых, занимавшихся исследованием электронной конфигурации, был немецкий физик Йоганн Бальмер. Он разработал формулу Бальмера, позволяющую предсказывать уровни энергии атомов водорода и электронные переходы в них. Эта формула была важным шагом в изучении электронной структуры атомов и сыграла ключевую роль в дальнейших исследованиях.
В начале XX века ученые Нильс Бор и Эрвин Шредингер разработали квантовую механику, которая стала основой для теории электронной структуры атомов. Бор предложил модель атома, в которой электроны двигаются по орбитам вокруг ядра и могут совершать переходы между этими орбитами. Шредингер разработал уравнение, описывающее движение электронов с учетом их волновых свойств.
С помощью новых теоретических концепций и экспериментальных методов, ученые стали исследовать электронную структуру различных элементов, включая двухвалентные металлы. Они выяснили, что электронная конфигурация этих металлов соответствует общей электронной формуле 1s2 2s2 2p6 3s1.
Таким образом, исследование электронной конфигурации двухвалентных металлов основывается на принципах квантовой механики и позволяет более глубоко понять их химические свойства и способность образовывать ионы с двойным положительным зарядом.
Существование ионов двухвалентных металлов с электронной конфигурацией 1s2 2s2 2p6 3s1: реальность или фантазия?
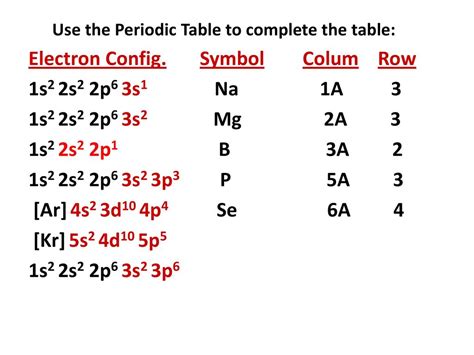
Электронная конфигурация 1s2 2s2 2p6 3s1 принадлежит атомам элементов, где последний электрон находится в оболочке 3s и не может быть отщеплен для образования иона. Следовательно, с точки зрения общепринятой концепции ионного образования, ионы двухвалентных металлов с такой электронной конфигурацией не существуют. Однако, существуют ионы двухвалентных металлов с другими электронными конфигурациями.
Ионы двухвалентных металлов имеют общую электронную конфигурацию 1s2 2s2 2p6. Они достигают стабильной электронной конфигурации, отдавая два электрона из последнего энергетического уровня. Примерами таких ионов являются Fe2+ (железо), Zn2+ (цинк), Cu2+ (медь) и другие. Ионы данных металлов широко используются в различных химических реакциях и процессах.
Таким образом, ионы двухвалентных металлов с электронной конфигурацией 1s2 2s2 2p6 3s1 не являются реальностью в рамках установленной системы нумерации ионов. Однако, есть возможность существования ионов двухвалентных металлов с другими электронными конфигурациями, которые обладают значительным химическим и физическим потенциалом.
Влияние электронной конфигурации на свойства ионов двухвалентных металлов
Ионизация двухвалентных металлов происходит за счет потери двух электронов из валентной оболочки. При этом, электронная конфигурация ионов двухвалентных металлов может оказывать существенное влияние на их свойства.
Первоначальная электронная конфигурация металлического атома в основном состоянии определяет количество электронов во внешней оболочке стал при ионизации ионами двухвалентных металлов. Например, ион магния Mg^2+ с электронной конфигурацией [Ne] 3s2, ион железа Fe^2+ с конфигурацией [Ar] 3d6, ион цинка Zn^2+ с конфигурацией [Ar] 3d10.
- При ионизации атом теряет электроны из валентной оболочки, что ведет к сокращению размера иона и увеличению числа заряженных ядер в отношении перед элементом в периодической таблице.
- С изменением электронной конфигурации меняются и химические свойства иона. Например, ионы металлов с полностью заполненными s- и d-оболочками (например, ионы цинка Zn^2+ и кадмия Cd^2+) обладают большей устойчивостью и меньшей активностью, по сравнению с ионами, у которых d-оболочка не полностью заполнена.
- Ионы двухвалентных металлов с различными электронными конфигурациями могут образовывать различные соединения и вступать в разные химические реакции. Это обусловлено разными степенями окисления и разными способностями ионов вступать в соединения с другими веществами.
Таким образом, электронная конфигурация играет значительную роль в определении свойств ионов двухвалентных металлов, таких как размер, устойчивость, активность и химические реакции, которые они могут проводить.
Вопрос-ответ
Какие ионы двухвалентных металлов могут существовать?
Ионы двухвалентных металлов могут иметь электронную конфигурацию 1s2 2s2 2p6 3s2.
Что означает электронная конфигурация 1s2 2s2 2p6 3s2?
Электронная конфигурация 1s2 2s2 2p6 3s2 означает, что в атоме на первом энергетическом уровне находятся 2 электрона, на втором энергетическом уровне 2 электрона, на третьем энергетическом уровне 6 электронов, и на четвертом энергетическом уровне 2 электрона.
Может ли ион двухвалентного металла иметь электронную конфигурацию 1s2 2s2 2p6 3s1?
Ионы двухвалентных металлов имеют обычно электронную конфигурацию 1s2 2s2 2p6 3s2. Электронная конфигурация 1s2 2s2 2p6 3s1 указывает на наличие одного несвязанного электрона на третьем энергетическом уровне, что не характерно для двухвалентных ионов.
Могут ли ионы двухвалентных металлов иметь различные электронные конфигурации?
Ионы двухвалентных металлов имеют обычно одну и ту же электронную конфигурацию: 1s2 2s2 2p6 3s2. В данной конфигурации все энергетические уровни заполнены, и ион становится стабильным.
