Электродный потенциал неактивного металла является одним из ключевых факторов, определяющих его поведение в электрохимических системах. Этот потенциал возникает в результате сложных химических и физических процессов, которые происходят на поверхности металла взаимодействия с окружающей средой.
Процесс образования электродного потенциала начинается с образования двойного электрического слоя на поверхности металла. В этом процессе ионы окружающей среды адсорбируются на поверхности металла, что приводит к образованию слоя заряженных частиц. Этот слой является областью раздела между металлом и окружающей средой и называется электрическим двойным слоем.
Далее, происходит процесс переноса электронов между металлом и окружающей средой через электрический двойной слой. Этот процесс называется реакцией окисления-восстановления и является ответственным за возникновение электродного потенциала. При этом, электродный потенциал неактивного металла может быть либо положительным, либо отрицательным, в зависимости от его электрохимической активности.
Таким образом, электродный потенциал неактивного металла является результатом сложных химических реакций, происходящих на его поверхности. Понимание механизмов образования и влияния электродного потенциала позволяет контролировать и оптимизировать его поведение в различных электрохимических системах.
Определение электродного потенциала
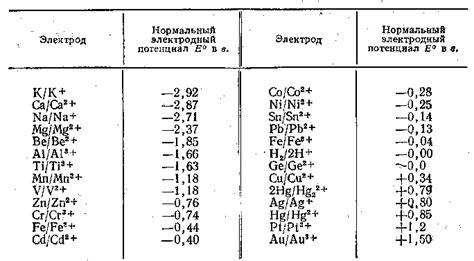
Электродный потенциал – это величина, характеризующая силу, с которой электроны перемещаются относительно стандартного водородного электрода (СВЭ) на поверхности металла. Это один из основных показателей реактивности металла и его способности проводить электрический ток.
Определение электродного потенциала происходит путем сравнения потенциала относительно других материалов при помощи специальной установки. Для определения потенциала выступает референсный электрод, который стандартизирован и измеряет величину потенциала по отношению к нему.
Наибольший электродный потенциал имеет металл, который находится в самой высокой позиции в ряду напряжений металлов. Наибольшей известной величиной электродного потенциала обладает литий, а наименьшей - фтор. Наиболее важным является сравнительное значение электродного потенциала, основанное на масштабированной шкале по отношению к СВЭ.
Роль электродного потенциала в электрохимических процессах
Электродный потенциал играет важную роль в электрохимических процессах, определяя направление и скорость химических реакций на электродах. Он представляет собой меру того, насколько легко или трудно происходит перенос электронов на электроде.
Высокий электродный потенциал говорит о большой способности электрода принимать электроны, в то время как низкий электродный потенциал указывает на его слабую способность к этому. Имея разные электродные потенциалы, разные металлы могут растворяться или осаждаться на электродах в электролите.
При возникновении разности электродных потенциалов между двумя электродами, возникает электрическое поле, которое приводит к электродному потенциалу разницы между двумя электродами. Эта разность потенциалов толкает электроны от электрода с более низким потенциалом к электроду с более высоким потенциалом, вызывая тем самым электролиз или гальваническую реакцию.
В электрохимических процессах, электродный потенциал также играет ключевую роль в определении электрической энергии, полученной или расходуемой в процессе. Чем выше электродный потенциал, тем больше энергии можно получить при использовании такого электрода в батарее или в других устройствах хранения энергии.
Механизм возникновения электродного потенциала
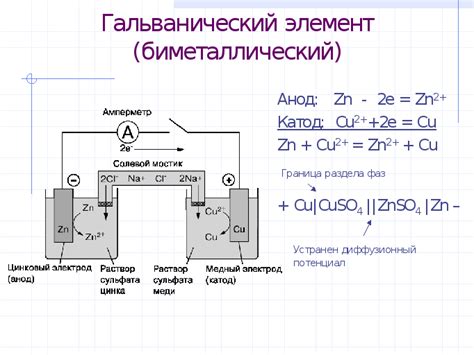
Электродный потенциал является важным показателем активности металла в электрохимической системе. Процесс его возникновения обусловлен реакцией между поверхностными слоями материала и окружающей средой. Когда металл погружается в раствор или контактирует с другим металлом, на его поверхности образуется двояко заряженный электрический двойной слой.
Возникновение электродного потенциала связано с разницей электрохимической активности между материалом и окружающей средой. Если металл является активным, то он будет выступать в качестве анода и освобождать электроны, передавая их на катод, который может быть другим металлом или раствором. В результате этого процесса металл будет подвергаться коррозии.
Если же металл является неактивным, то он обладает более низкой активностью, чем окружающая среда. В этом случае металл будет выступать в качестве катода и принимать электроны с анода, что приведет к образованию электродного потенциала. Это позволяет неактивному металлу иметь стабильную поверхность и не подвержен коррозии.
Таким образом, механизм возникновения электродного потенциала неактивного металла обусловлен его низкой активностью в сравнении с окружающей средой. Это позволяет металлу сохранять свою поверхность и обеспечивает его стабильность в электрохимической системе.
Взаимодействие металла с окружающей средой
Металл – это материал, который обладает хорошей электропроводностью и может использоваться как электрод в электрохимических системах. Взаимодействие металла с окружающей средой играет важную роль в электрохимических процессах, таких как коррозия и возникновение электродного потенциала.
В окружающей среде металл сталкивается с различными реагентами, такими как вода, кислород, ионы металлов и другие вещества. Эти реагенты могут влиять на электродный потенциал металла, вызывая его изменение и возникновение коррозии.
Концентрация реагента в окружающей среде имеет большое значение для взаимодействия с металлом. Высокая концентрация реагента может ускорить процесс коррозии, в то время как низкая концентрация может замедлить его. Например, высокая концентрация кислорода в воде может привести к активному окислению металла и ускоренной коррозии.
Температура окружающей среды также влияет на взаимодействие металла с окружающими реагентами. При повышении температуры скорость коррозии может увеличиваться, так как химические реакции обычно протекают быстрее при повышенной температуре.
Взаимодействие металла с окружающей средой может быть представлено в виде электрохимической реакции, в которой металл служит анодом или катодом. Электрохимический процесс может быть описан с использованием электродных потенциалов, которые определяются электрохимической активностью металла и концентрацией реагента. В результате такого взаимодействия между металлом и окружающей средой возникает электродный потенциал, который является основой для возникновения электрохимических процессов.
Образование электрического двойного слоя
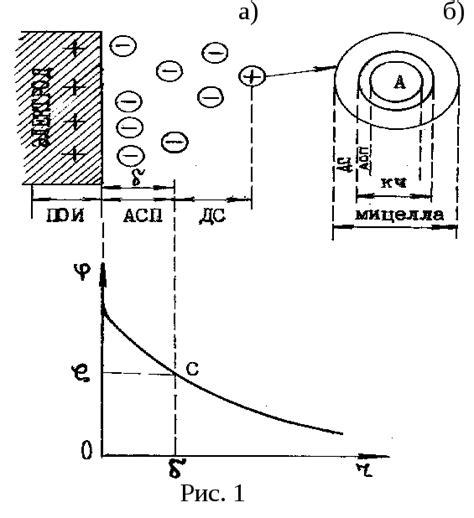
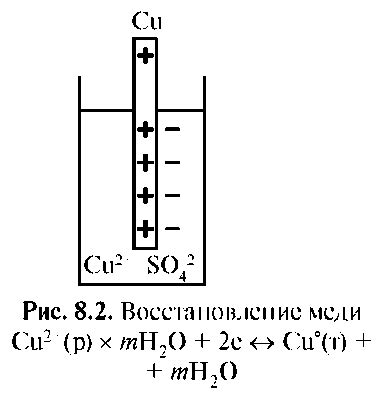
Образование электрического двойного слоя - это основной механизм, обусловливающий возникновение электродного потенциала на поверхности неактивного металла. Этот процесс происходит при контакте металла с электролитом или раствором, и заключается в образовании специфической структуры на границе раздела металл-электролит.
В электрическом двойном слое изолирующая пленка, состоящая из дипольноориентированных электролитических частиц, разделяет поверхность металла и электролит. В результате этого образуется зарядовый слой, в котором на поверхности металла накапливаются отрицательные заряды, а в среде электролита - положительные. Это приводит к возникновению электрического поля на границе раздела.
Формирование электрического двойного слоя обусловлено термодинамическим равновесием. Постоянное движение зарядов между металлом и электролитом поддерживает разницу потенциалов между двумя ионами, что в свою очередь приводит к возникновению электродного потенциала на поверхности неактивного металла.
Электрический двойной слой играет важную роль в электрохимических процессах, таких как электроосаждение, коррозия и гальванические реакции. Понимание механизмов образования и функционирования электрического двойного слоя позволяет эффективно управлять этими процессами и использовать их в различных технологических приложениях.
Окислительно-восстановительные реакции на границе фаз
На границе фаз неактивного металла происходят окислительно-восстановительные реакции, которые играют важную роль в возникновении электродного потенциала. Эти реакции возникают в результате взаимодействия неактивного металла с окружающей средой, например, с водой или растворами электролитов.
Окислительно-восстановительные реакции представляют собой процессы передачи электронов между различными веществами на границе фаз. В результате этих реакций происходит изменение степени окисления вещества и, как следствие, позволяет возникнуть разности потенциалов.
В окислительно-восстановительных реакциях на границе фаз неактивного металла происходит участие двух основных видов причастных частей - окислителя и восстановителя. Окислитель - это вещество, которое получает электроны, при этом его степень окисления увеличивается. Восстановитель - это вещество, которое отдает электроны, при этом его степень окисления уменьшается.
Примером окислительно-восстановительной реакции на границе фаз может быть процесс окисления металла в воде. Металл, например, железо, выступает в роли восстановителя, отдавая электроны. Вода, в свою очередь, выступает в роли окислителя, принимая электроны и восстанавливаясь. Таким образом, на границе фаз между железом и водой происходит передача электронов, что и вызывает возникновение электродного потенциала.
Диффузия и электролитическое растворение металла
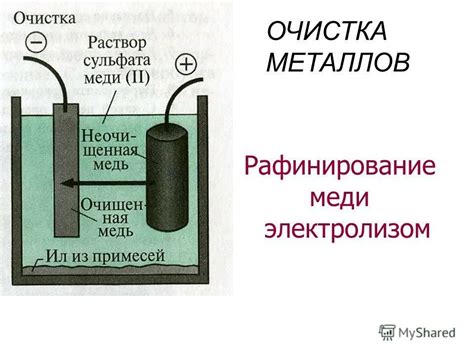
Диффузия и электролитическое растворение металла являются важными процессами, определяющими механизм возникновения электродного потенциала неактивного металла. Диффузия представляет собой движение атомов или ионов металла внутри его структуры или через границы его частиц. Этот процесс позволяет металлу распространяться и перемещаться на микроскопическом уровне.
Электролитическое растворение металла, или коррозия, происходит в присутствии электролита, который действует как проводник для электрического тока. В процессе электролитического растворения, ионы металла переходят из твердой фазы в раствор под воздействием электрического поля. Этот процесс может приводить к разрушению металлической структуры и образованию различных коррозионных продуктов.
Важной особенностью диффузии и электролитического растворения металла является их взаимосвязь. Диффузия может способствовать проникновению электролита внутрь металла, увеличивая тем самым скорость электролитического растворения. В свою очередь, электролитическое растворение может влиять на диффузионные процессы, изменяя структуру металла и его электрические свойства.
Диффузия и электролитическое растворение металла тесно связаны с формированием электродного потенциала неактивного металла. В процессе диффузии и электролитического растворения, металл взаимодействует с окружающей средой, что может привести к образованию электрокемической ячейки и возникновению электродного потенциала. Этот потенциал определяет, будет ли металл активным или пассивным в данной среде.
Эффект концентрационной поляризации
Эффект концентрационной поляризации является одним из факторов, определяющих механизм возникновения электродного потенциала неактивного металла. В процессе работы электрохимических систем возникают различные концентрационные градиенты, которые могут вызвать изменение потенциала электрода.
Эффект концентрационной поляризации связан с диффузией вещества к поверхности металла. При наличии различных концентраций реагентов в ближайшей окружающей среде электрода, происходит диффузия вещества через двойной электрический слой к поверхности металла. Это приводит к изменению состава раствора на поверхности металла и, соответственно, к изменению электродного потенциала.
Интенсивность эффекта концентрационной поляризации зависит от разности концентраций вещества на поверхности металла и в удаленной от поверхности области раствора. Чем больше разность концентраций, тем выше интенсивность поляризации.
Эффект концентрационной поляризации может быть положительным или отрицательным, в зависимости от направления диффузии вещества и его влияния на электродный потенциал. Положительная поляризация означает повышение потенциала электрода, а отрицательная - снижение.
Эффект концентрационной поляризации имеет большое значение в электрохимических системах, где происходит активное взаимодействие с реагентами. Он может влиять на процессы коррозии и окисления-восстановления, а также на скорость электрохимических реакций.
Механизмы коррозии неактивных металлов
Коррозия неактивных металлов – это процесс разрушения материала под влиянием химических или электрохимических воздействий окружающей среды. Неактивные металлы, такие как алюминий, медь и нержавеющая сталь, обладают стабильностью и устойчивостью к коррозии в обычных условиях.
Одним из механизмов коррозии неактивных металлов является окисление. При взаимодействии металла с кислородом происходит образование окисной пленки на поверхности металла. Эта пленка может быть защитной и не пропускать влагу и кислород, что способствует сохранению металла в исходном состоянии. Однако, в некоторых условиях окисная пленка может разрушаться, что приводит к коррозии.
Другим механизмом коррозии является адгезивная коррозия. Она возникает при соприкосновении неактивного металла с другим металлом или материалом, таким как соль, кислота или вода. В результате обмена электронами между металлом и агрессивной средой возникает разрушение поверхности металла и образование коррозийных продуктов.
В некоторых случаях, коррозия неактивных металлов может быть вызвана электролитической коррозией. Этот механизм коррозии возникает при наличии электролита, который является проводником электрического тока. При наличии электролита, катодная и анодная области на поверхности металла образуются, что способствует разрушению металла.
Обратная электрохимическая реакция также может быть механизмом коррозии неактивных металлов. При этой реакции происходит ускоренная восстановление окисленного металла при наличии редуцирующих агентов. Это может привести к разрушению структуры металла и образованию коррозионных продуктов.
Выводы
Таким образом, возникновение электродного потенциала неактивного металла обусловлено различием в реакционной способности его поверхности и раствора с электролитом.
При контакте металла с раствором происходит образование электродной двойного слоя, в котором на поверхности металла образуется отрицательный заряд, что создает электродный потенциал металла.
Важным фактором в формировании электродного потенциала является степень активности металла, которая определяется его реакционной способностью. Чем выше степень активности, тем более высокий будет электродный потенциал металла.
Также следует отметить, что электродный потенциал неактивного металла может изменяться под влиянием различных факторов, таких как температура, концентрация раствора и другие химические параметры.
Изучение механизма возникновения электродного потенциала неактивного металла имеет практическое значение для понимания процессов, происходящих при коррозии и других электрохимических реакциях, а также для разработки эффективных методов защиты металлических конструкций от коррозии.
Вопрос-ответ
Каким образом возникает электродный потенциал неактивного металла?
Механизм возникновения электродного потенциала неактивного металла основан на электрохимической реакции металла с окружающей его средой. Неактивный металл взаимодействует с ионами водорода или другими реагентами, образуя два электрода: основной (неактивный металл) и вторичный (растворенные ионы водорода или другие реагенты).
Какие факторы влияют на величину электродного потенциала?
Величина электродного потенциала неактивного металла зависит от ряда факторов, таких как концентрация реагентов, температура, давление и pH значения водного раствора. Кроме того, величина электродного потенциала может быть изменена с помощью добавления электролитических растворов или введения иных реагентов.
Каким образом изменение концентрации реагентов влияет на электродный потенциал неактивного металла?
Изменение концентрации реагентов влияет на электродный потенциал неактивного металла. Увеличение концентрации реагентов приводит к увеличению электродного потенциала, а уменьшение концентрации - к его уменьшению. Это происходит из-за изменения активности ионов в растворе, что приводит к изменению концентрации электролитов и, соответственно, к изменению электродного потенциала.
Как температура влияет на электродный потенциал неактивного металла?
Температура является важным фактором, влияющим на электродный потенциал неактивного металла. При повышении температуры электродный потенциал увеличивается, а при понижении температуры - уменьшается. Это связано с изменением активности ионов в растворе, а также с изменением скорости химических реакций между металлом и реагентами.