Существует ли возможность образования двухатомных молекул у металлов - вопрос, который часто вызывает интерес в области химии. В то время как металлы обычно образуют кристаллическую решетку, состоящую из бесконечных трехмерных сетей атомов, возникновение двухатомных молекул может быть рассмотрено с практической и теоретической точек зрения.
На первый взгляд может показаться, что металлы не образуют двухатомные молекулы, так как их электронное строение и химические связи отличаются от этих характеристик у неметаллических элементов. Электронное строение металлов характеризуется наличием "моря" свободных электронов, которые могут двигаться свободно между атомами в решетке.
Однако, существуют ряд исключений, где некоторые металлы могут формировать двухатомные молекулы. Примером такого явления являются некоторые газообразные металлы, такие как гелий, который при низких температурах может образовывать молекулы He2. Также молекулы Hg2, состоящие из двух атомов ртути, были обнаружены в паровой фазе при высоких температурах и низком давлении.
В целом, можно сделать вывод, что металлы обычно не формируют двухатомные молекулы из-за их особенностей электронного строения и химических связей. Однако, существует несколько исключительных случаев, где некоторые металлы могут образовывать двухатомные молекулы, обладающие особыми свойствами.
Металлы и двухатомные молекулы
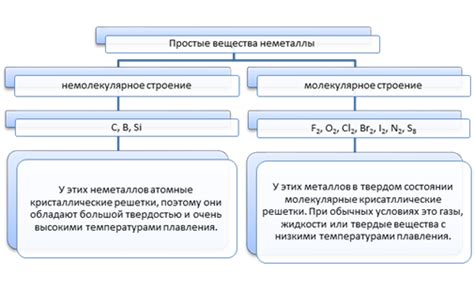
Металлы, как правило, образуют кристаллическую решетку, состоящую из положительных ионов, окруженных электронами в форме облака. Из-за такой структуры металлы не образуют двухатомные молекулы в обычных условиях.
Однако существует некоторое количество исключений, когда металлы могут образовывать двухатомные молекулы. Например, некоторые галогены, такие как бром и йод, могут образовывать двухатомные молекулы с металлом, таким как медь или железо.
При этом формирование двухатомных молекул с металлами чаще всего происходит при высоких температурах и давлениях, когда структура металла изменяется и возникают условия для образования двухатомных связей.
Таким образом, можно сказать, что в обычных условиях металлы не образуют двухатомные молекулы, но в определенных условиях такая возможность не исключена. Это является интересной особенностью и позволяет изучать разнообразные свойства металлов и их способность к образованию химических связей.
Металлы и их свойства
Металлы – это класс веществ, обладающих специфическими физическими и химическими свойствами. Они обычно обладают высокой теплопроводностью и электропроводностью, а также высокой пластичностью и прочностью. Металлы широко применяются в различных областях, таких как строительство, электроника, машиностроение и многих других.
Одноатомная структура металлов. Металлы в своей чистой форме обычно образуют кристаллическую решётку, состоящую из одноатомных ионов металла. Эта структура обеспечивает им характерные свойства, такие как металлический блеск и способность проводить электричество.
Вещественные металлы. Вещественные металлы, такие как железо, медь и алюминий, могут быть прочные и иметь высокую пластичность. Они образуют множество разнообразных сплавов с другими металлами, что позволяет им обладать различными механическими свойствами и быть применяемыми для различных целей.
Двухатомные молекулы металлов. Некоторые металлы, такие как ртуть и галлий, могут образовывать двухатомные молекулы в паровой фазе при определенных условиях. Эти двухатомные молекулы имеют особые свойства, которые отличаются от свойств одноатомных структур металлов.
В целом, металлы обладают широкими и разнообразными свойствами, что делает их важными и неотъемлемыми составляющими многих сфер нашей жизни.
Образование двухатомных молекул
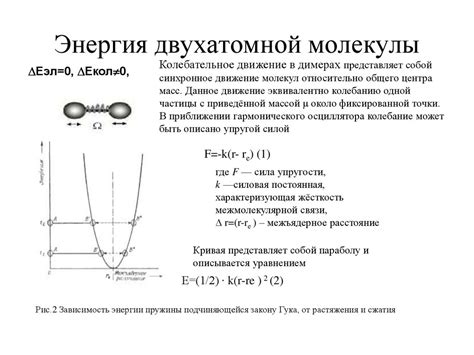
Металлы, в отличие от неметаллов, образуют сложные кристаллические структуры, в которых атомы металла связаны между собой металлическими связями. Однако в определенных условиях, металлы могут образовывать и двухатомные молекулы.
Образование двухатомных молекул металлов может происходить при высоких температурах или высоких давлениях. В этих условиях, металлические связи между атомами металла ослабевают, и атомы начинают образовывать пары или кластеры.
Образование двухатомных молекул у металлов имеет свои особенности. Например, у некоторых металлов, таких как гелий и неон, двухатомные молекулы образуются только при очень низких температурах. У других металлов, таких как кислород и азот, двухатомные молекулы могут существовать при обычных условиях.
Образование двухатомных молекул металлов имеет большое значение для различных отраслей науки и техники. Например, молекулы металлов могут использоваться в процессах катализа, электрохимии, и в производстве материалов с особыми свойствами. Кроме того, изучение молекулярной структуры металлов позволяет получить новые сведения о свойствах металлов и развивать новые технологии и материалы.
Примеры металлов с двухатомными молекулами
Многие металлы могут образовывать двухатомные молекулы, состоящие из двух атомов металла. Это происходит при наличии особенной структуры и особенностей химической связи между атомами.
Один из примеров таких металлов - активный щелочной металл натрий (Na). В его двухатомной молекуле оба атома натрия образуют ковалентную связь, в результате которой они обмениваются электронами и образуют молекулярный ион Na2+. Такая молекула обладает стабильностью и используется, например, в химической промышленности.
Другим примером металла, образующего двухатомную молекулу, является ртуть (Hg). В молекуле ртути оба атома образуют ковалентную связь. Это явление обусловлено специфическими электронными уровнями ртути и возможностью обмена электронами.
Кроме натрия и ртути, кислород (O) также способен образовывать двухатомные молекулы с различными металлами. Например, в молекуле оксида железа (FeO) присутствуют два атома кислорода, связанные с атомом железа ковалентной связью.
Таким образом, можно сделать вывод, что некоторые металлы способны образовывать стабильные двухатомные молекулы, что делает их уникальными и интересными объектами для изучения в химии.
Вопрос-ответ
Какие металлы образуют двухатомные молекулы?
Двухатомные молекулы встречаются редко среди металлов, однако положительным исключением являются некоторые металлы, такие как марганец, хром, железо, никель и кобальт. Они способны образовывать стабильные двухатомные молекулы благодаря их валентности и специфической электронной структуре.
Какие свойства обладают двухатомные молекулы металлов?
Двухатомные молекулы металлов обладают рядом уникальных свойств. Они обычно обладают высокой стабильностью, низкой реактивностью и способностью образовывать сильные межатомные связи. Эти молекулы также могут быть магнитными и иметь специфическую реакционную активность.
Каким образом металлы образуют двухатомные молекулы?
Металлы образуют двухатомные молекулы путем обмена электронами. Обычно это происходит при высоких температурах или в условиях высокого давления. Вследствие этого обмена электронами образуется стабильная молекула, состоящая из двух атомов металла.
Какова основная причина образования двухатомных молекул металлов?
Основной причиной образования двухатомных молекул металлов является их способность образовывать ковалентные связи с другими атомами. Это свойство обусловлено валентностью металла и его электронной структурой. Как правило, двухатомные молекулы металлов образуются с теми атомами или группами атомов, которые имеют подходящую валентность и могут предоставить металлу необходимое число электронов для образования молекулы.
Какова роль двухатомных молекул металлов в химических реакциях?
Двухатомные молекулы металлов играют важную роль во многих химических реакциях. Они могут служить как источник электронных или атомных групп для других реагентов, а также принимать участие в реакциях, которые требуют особой структуры или электронной конфигурации молекулы. Также они могут быть активированы при взаимодействии с другими веществами и использоваться в качестве катализаторов реакций.
