Структура атома металла является важной характеристикой, которая определяет его свойства и взаимодействия с другими веществами. В свою очередь, распределение электронов по энергетическим уровням играет существенную роль в формировании этой структуры. Исследование этой темы позволяет понять основные закономерности и особенности данного процесса, которые определяют физические и химические свойства металлов.
Атом металла состоит из ядра, вокруг которого движутся электроны. Электроны занимают различные энергетические уровни, которые определяются их энергией. Первый энергетический уровень ближе всего к ядру и имеет наиболее низкую энергию, а последующие энергетические уровни располагаются дальше от ядра и имеют более высокие энергии.
Распределение электронов по энергетическим уровням подчиняется принципу Паули, который устанавливает, что в одном атоме не может находиться два электрона с одинаковым набором квантовых чисел. Следовательно, каждый энергетический уровень может содержать ограниченное количество электронов. Например, первый энергетический уровень может содержать не более 2 электронов, второй - не более 8, третий - не более 18 и т.д.
Особенности распределения электронов по энергетическим уровням в атомах металлов могут быть объяснены с помощью модели электронного газа. Согласно этой модели, электроны в металлах заполняют наиболее низкие доступные энергетические уровни, начиная с наименьшего и продвигаясь к более высоким. Благодаря этому, металлы обладают хорошей электропроводностью и теплопроводностью, так как электроны могут свободно двигаться по всему объему металла.
Атомы металлов
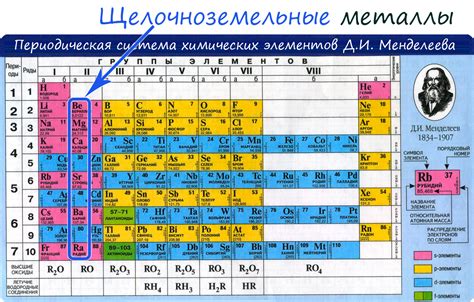
Металлы – это класс веществ, обладающих характерными свойствами, такими как хорошая тепло- и электропроводность, металлический блеск, пластичность и др. В основе этих свойств лежит организация атомов металла и его электронная структура.
Атом металла состоит из ядра, в котором находятся протоны и нейтроны, а также облака электронов, движущихся по энергетическим уровням. Важно отметить, что электроны в атомах металлов обладают особенностями, которые отличают их от электронов в атомах других элементов.
В металлах электроны находятся внутри валентной оболочки, которая может быть заполнена различными способами. Например, многие атомы металлов имеют электронную конфигурацию, в которой последние s- и p-орбитали заполнены частично, а d- и f-орбитали полностью заполнены.
Распределение электронов по энергетическим уровням в атомах металлов обусловлено соответствующими квантовыми правилами и закономерностями. Атомы металлов стремятся к наиболее устойчивой электронной конфигурации, которая обеспечивается определенным количеством электронов на каждом энергетическом уровне.
Распределение электронов
Распределение электронов по энергетическим уровням в атомах металлов является важной характеристикой, которая влияет на их химические и физические свойства. Каждый атом металла имеет определенное количество энергетических уровней, на которых могут находиться его электроны.
Согласно принципу запрета Паули, в одной орбитали может находиться не более двух электронов с противоположным спином. Из этого принципа следует, что энергетические уровни металла заполняются электронами по принципу минимальной энергии.
Наиболее низкая энергия соответствует первому электронному уровню, который состоит из одной s-орбитали. Второй электронный уровень состоит из двух электронных орбиталей: s- и p-орбиталей. Третий электронный уровень включает s-, p- и d-орбитали, а четвертый электронный уровень содержит s-, p-, d- и f-орбитали.
Таким образом, распределение электронов по энергетическим уровням в атомах металлов имеет свои закономерности, которые определены структурой электронных орбиталей. Это распределение влияет на химические свойства металлов, так как электроны с различной энергией могут участвовать в химических взаимодействиях и образовании химических связей.
Энергетические уровни
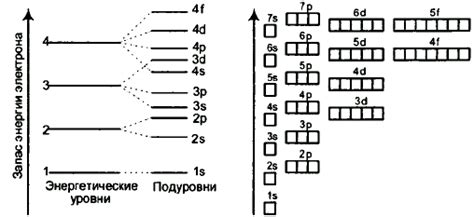
Электроны в атомах металлов распределены по энергетическим уровням, которые представляют собой различные энергетические состояния электрона в атоме. Каждый энергетический уровень имеет определенную энергию, которая может быть измерена в электрон-вольтах (эВ).
В атоме металла энергетические уровни разделены на подуровни, которые характеризуются различными значениями момента импульса электрона. Подуровни обозначаются буквами s, p, d, f и имеют 1, 3, 5 и 7 возможных ориентаций момента импульса соответственно.
Количество энергетических уровней в атоме металла зависит от числа электронов в его внешних энергетических оболочках. При последовательном заполнении уровней электроны первоначально заполняют наиболее низкие энергетические уровни, а затем переходят на более высокие уровни.
- На самом низком энергетическом уровне находится 1s-подуровень, на котором может находиться до 2 электронов.
- На следующем уровне находятся 2s-подуровень и 2p-подуровни, на которых может находиться до 8 электронов.
- На третьем уровне находятся 3s-подуровень, 3p-подуровни и 3d-подуровни, на которых может находиться до 18 электронов.
Такой порядок заполнения уровней электронами является результаом принципа Паули и правил заполнения электронными парами, который обусловлен стремлением электронов к наиболее стабильным энергетическим состояниям.
Особенности распределения
Распределение электронов по энергетическим уровням в атомах металлов имеет ряд особенностей, связанных с их строением и свойствами. Во-первых, атомы металлов имеют большое количество электронов, что определяется их атомным номером в периодической системе.
Во-вторых, электроны в атомах металлов распределены по энергетическим уровням, причем каждый уровень может содержать определенное количество электронов. В этом распределении соблюдается принцип заполнения, согласно которому электроны на более низких энергетических уровнях заполняются первыми.
Также следует отметить, что электроны в атомах металлов не могут находиться на произвольных энергетических уровнях, а могут находиться только на определенных дискретных уровнях энергии, которые формируют энергетический спектр атома.
Кроме того, в атомах металлов существуют так называемые запрещенные зоны, в которых отсутствуют электроны. Это связано с тем, что атомы металлов обладают характерными свойствами проводимости электрического тока, и электроны находятся во внешней оболочке атома.
Таким образом, особенности распределения электронов по энергетическим уровням в атомах металлов обусловлены их большим количеством, принципом заполнения, дискретностью энергетических уровней и наличием запрещенных зон, что является важным для понимания свойств и поведения металлов.
Закономерности распределения

Распределение электронов по энергетическим уровням в атомах металлов подчиняется определенным закономерностям, которые определяют их электронную конфигурацию и химические свойства. Одной из важных закономерностей является принцип запрещенных зон.
Согласно принципу запрещенных зон, электронное состояние в атоме металла может быть либо заполнено электронами, либо полностью пустым. То есть электроны заполняют энергетические уровни последовательно, начиная с наименьших энергий и двигаясь к более высоким. Каждый энергетический уровень может содержать определенное количество электронов, определяемое принципом Паули, согласно которому каждому электрону присваивается уникальный квантовый числовой набор.
Важной особенностью распределения электронов является альтернанс электронных орбиталей. Он определяет строение электронных оболочек и систематическую смену энергетических уровней при заполнении. Например, электроны населяют оболочки разных энергий последовательно: сначала заполняются s-орбитали, затем p-орбитали, а далее d- и f-орбитали. Это связано с особенностями структуры электронных оболочек и энергетическими характеристиками орбиталей.
Закономерности распределения электронов играют важную роль в объяснении химических свойств металлов. Например, электроны валентной оболочки, находящиеся на наиболее высоких энергетических уровнях, обладают большей подвижностью и отвечают за металлические свойства металлов, такие как электропроводность и теплопроводность. Понимание закономерностей распределения электронов позволяет предсказывать и объяснять химическую активность металлов и их способность образовывать соединения.
Вопрос-ответ
Как распределяются электроны по энергетическим уровням в атомах металлов?
В атомах металлов электроны распределяются по энергетическим уровням в соответствии с принципом заполнения энергетических уровней. Сначала заполняются уровни с более низкой энергией, а затем постепенно переходят на уровни с более высокой энергией.
Какие особенности и закономерности связаны с распределением электронов по энергетическим уровням в атомах металлов?
Основной особенностью распределения электронов в атомах металлов является наличие заполненной оболочки внутренних энергетических уровней и незаполненной оболочки внешних энергетических уровней. Закономерностями являются принцип заполнения энергетических уровней и соблюдение правила Гунда.
Как принцип заполнения энергетических уровней влияет на свойства металлов?
Принцип заполнения энергетических уровней определяет структуру электронного облака атома металла, что, в свою очередь, влияет на его свойства. Заполненная внутренняя оболочка энергетических уровней делает атом металла стабильным, а незаполненная внешняя оболочка обеспечивает его химическую активность.
Какие закономерности связаны с распределением электронов в атомах металлов?
Закономерностью, связанной с распределением электронов в атомах металлов, является правило Гунда, которое утверждает, что электроны заполняют энергетические уровни один за другим, начиная с нижних. Также существует закономерность в виде табличного расположения электронной конфигурации элементов в периодической системе, которая отражает постепенное заполнение энергетических уровней.
Можете рассказать о правиле Гунда и его влиянии на распределение электронов в атомах металлов?
Правило Гунда гласит, что электроны в атомах заполняют энергетические уровни в порядке возрастания энергии. Сначала заполняется уровень с наименьшей энергией, затем следующий за ним и так далее. Это правило определяет порядок заполнения подуровней s, p, d, f и важно для понимания распределения электронов в атомах металлов.
