Электронная конфигурация является основой для понимания химических свойств элементов. Она определяет, как распределены электроны по энергетическим уровням и орбиталям в атоме. Каждому элементу характерна своя уникальная электронная конфигурация, и это влияет на его химическую активность.
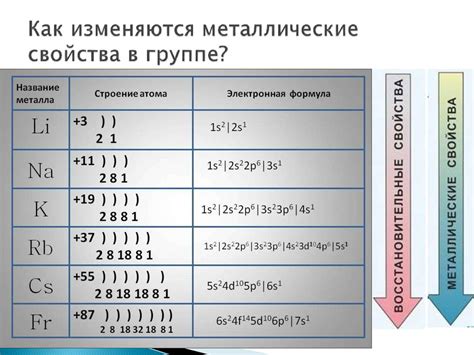
Более активные металлы находятся в левой части периодической системы элементов. Они имеют меньшую энергию ионизации, что позволяет им легко отдавать электроны. Наиболее активным металлом является франций (Fr), ионизационная энергия которого составляет всего 380 кДж/моль.
Однако, стоит учитывать и другие факторы, такие как электроотрицательность, размер атома и его структура. Например, калий (K) и кальций (Ca) также относятся к активным металлам, но они имеют более высокую ионизационную энергию по сравнению с францием.
Важность определения наиболее активного металла
Определение наиболее активного металла является важной задачей в химии, поскольку активность металла напрямую связана с его реакционной способностью. Активные металлы обладают высокой энергией связи и сильной способностью к окислению.
Определение наиболее активного металла основывается на его электронной конфигурации. Электронная конфигурация влияет на атомные свойства металла, такие как размер, заряд ядра и электронное облако. Более активные металлы обычно имеют меньший радиус и меньшую энергию ионизации.
Наиболее активные металлы в таблице периодических элементов находятся в верхней левой части, такие как литий (Li), натрий (Na) и калий (K). Эти металлы имеют одну валентную электрон, что делает их очень реактивными. Они легко отдают эту электрон и образуют ионы положительного заряда.
- Определение наиболее активного металла имеет важное практическое значение в различных областях химии и технологии. Например, он помогает в выборе металлов для производства батарей или коррозионно-стойкого оборудования.
- Знание о наиболее активных металлах также позволяет проводить безопасные химические реакции и предотвращать возможные взрывы или пожары при неправильном обращении с активными металлами.
- Определение наиболее активного металла также является основой для понимания ряда химических процессов, в том числе органического синтеза и растворения металлов.
В целом, определение наиболее активного металла помогает установить его химическую активность и определить его важность в различных химических процессах и приложениях. Это основа для различных экспериментов и исследований в области химии и материаловедения, которые могут привести к разработке новых материалов и технологий.
Понятие электронной конфигурации
Электронная конфигурация - это упорядоченное расположение электронов в электронных оболочках атома. Она определяет распределение электронов по энергетическим уровням и подуровням.
Электроны в атоме располагаются в разных электронных оболочках, которые имеют различную энергию. Сначала заполняются электроны на наименьших энергетических уровнях, а затем на более высоких. Каждый энергетический уровень может содержать определенное количество электронов.
Электронная конфигурация записывается с помощью обозначения электронных оболочек и подуровней. Например, обозначение 1s^2 означает, что на первом энергетическом уровне расположены 2 электрона в s-подуровне.
Электронная конфигурация помогает определить активность металлов. Наиболее активными металлами являются те, у которых внешний энергетический уровень не заполнен полностью. Они стремятся отдать электроны и образовать ионы положительного заряда. Такие металлы способны проявлять сильную активность в химических реакциях и обладать хорошей проводимостью электричества и тепла.
Критерии определения активности металла

Электронная конфигурация является одним из основных критериев определения активности металла. Атомы металлов со свободными электронами в внешней энергетической оболочке часто обладают высокой химической активностью. Чем больше электронов металл может потерять, тем более активным он считается. Например, металлы первой группы (щелочные металлы) имеют один свободный электрон в внешней оболочке и потому обладают высокой активностью.
Атомный радиус также влияет на активность металла. Чем меньше атомный радиус, тем более активным металл считается. Это связано с увеличением сил притяжения между ядром атома и его внешними электронами при уменьшении радиуса. Металлы с меньшими атомными радиусами обычно имеют больше возможностей для обмена или передачи электронов и, следовательно, проявляют высокую активность.
Электроотрицательность также является важным фактором. Металлы с низкой электроотрицательностью обычно обладают высокой активностью, так как они готовы отдавать свои электроны другим элементам. Например, щелочные металлы (металлы первой группы) обладают низкой электроотрицательностью и поэтому считаются наиболее активными металлами.
Потенциал окисления и редукции также можно использовать для определения активности металла. Потенциал окисления показывает, насколько легко металл может потерять электроны и образовать положительный ион. Чем выше потенциал окисления, тем более активным считается металл. Например, калий имеет большой потенциал окисления и считается одним из наиболее активных металлов.
Связь электронной конфигурации с активностью
Электронная конфигурация элемента определяет его способность к вступлению в химические реакции и проявлению активности. Понимание связи между электронной конфигурацией и активностью позволяет определить наиболее активные металлы.
Наиболее активными металлами являются те, у которых последний электрон находится в s- или p-оболочке, и они могут легко отдавать эти электроны при образовании химических связей. Такие элементы обладают меньшей энергией ионизации и электроотрицательностью, что способствует их более активному взаимодействию с другими веществами.
Например, элементы первой группы периодической системы, такие как литий (Li) и натрий (Na), имеют электронную конфигурацию с последним электроном в s-оболочке. Их низкая энергия ионизации позволяет им легко отдавать этот электрон и образовывать ионы с положительным зарядом, что делает их очень активными металлами.
С другой стороны, элементы в середине периодической системы, такие как железо (Fe) и медь (Cu), имеют электронную конфигурацию с последним электроном в d- или f-оболочке. Благодаря своей более сложной электронной структуре и высокой энергии ионизации, эти металлы проявляют меньшую активность и более слабое взаимодействие с другими веществами.
Таким образом, электронная конфигурация является важным фактором, определяющим активность металлов. Она определяет, как легко металл может отдать или получить электроны, что, в свою очередь, влияет на его способность к вступлению в химические реакции и образованию соединений.
Экспериментальные методы определения активности

Для определения активности металла по его электронной конфигурации существует несколько экспериментальных методов. Один из таких методов - измерение электротензионального ряда металлов. Для этого проводятся оокислительно-восстановительные реакции, в которых один металл участвует как окислитель, а другой - как восстановитель. Изменение потенциала при проведении реакции позволяет определить активность металла.
Другим методом определения активности металла является химическое обнаружение. Он основан на том, что активные металлы проявляют свою активность при реакции с определенными соединениями. Например, реакция металлов с кислородом, хлором или кислотами может показать их активность. Изменения веществ при реакции свидетельствуют о степени активности.
Также можно использовать метод масс-спектрометрии для определения активности металлов. При этом методе происходит ионизация металла и анализ массы ионов, что позволяет определить его активность. Этот метод является точным и позволяет проводить анализ металлов с высокой степенью активности.
Теоретические расчеты электронной конфигурации
При определении наиболее активного металла по его электронной конфигурации проводятся теоретические расчеты. Основой этих расчетов является знание о том, как располагаются электроны в атоме металла и какая энергия соответствует каждому электронному уровню.
Существуют различные модели, используемые для расчета электронной конфигурации, включая модель слоистого приближения, модель распределения электронов по энергетическим уровням и модель заполнения электронами оболочек.
Одним из ключевых понятий при определении активности металла является энергия ионизации. Энергия ионизации - это энергия, необходимая для удаления одного электрона из атома металла. Чем меньше энергия ионизации, тем более активным считается металл.
При расчете электронной конфигурации учитывается энергетика электронов и затраты энергии на образование ионов. Например, в модели заполнения электронами оболочек электроны располагаются по принципу минимизации энергии. Это значит, что электроны заполняют оболочки начиная с наиболее низкоэнергетической.
Имея информацию о теоретических расчетах электронной конфигурации металлов, можно определить, какой из них является наиболее активным. Эта информация может быть полезна в различных областях, таких как химическая промышленность и материаловедение.
Группы наиболее активных металлов
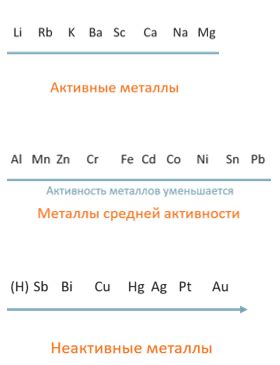
Наиболее активные металлы находятся в химической группе I и II периодической таблицы элементов. Они включают в себя щелочные металлы (литий, натрий, калий, рубидий, цезий и франций) из группы I, а также щелочноземельные металлы (бериллий, магний, кальций, стронций, барий и радий) из группы II.
Щелочные металлы характеризуются высокой реакционной способностью из-за того, что ион их металла легко отдают электроны. Они образуют стабильные и сильно ионизированные положительные ионы, что позволяет им образовывать соли с отрицательно заряженными ионами. Например, литий, наиболее активный металл из группы I, образует стабильный ион Li+, отдавая один электрон.
Щелочноземельные металлы менее активны, чем щелочные металлы, но все равно обладают высокой реакционной способностью. Они имеют два валентных электрона, которые они способны отдать, образуя двоякозарядные ионы. Например, магний, щелочноземельный металл из группы II, образует ион Mg2+ путем отдачи двух электронов.
Активность металлов связана с их электронной конфигурацией, а именно с количеством электронов в внешней оболочке. Чем меньше количество электронов в внешней оболочке, тем выше активность металла. Это связано с тем, что такие металлы стремятся отдать электроны и достичь стабильной октетной конфигурации. В результате этой активности, они легко реагируют с другими веществами, как воздухом, так и жидкостями или газами.
Важность определения активного металла в различных областях
Определение активного металла по его электронной конфигурации является важным заданием во многих областях науки и промышленности. Активные металлы обладают высокой реактивностью, что делает их незаменимыми в различных процессах и приложениях.
В химической промышленности, определение активного металла позволяет эффективно выбирать подходящий катализатор для различных химических реакций. Например, для производства аммиака необходим катализатор на основе активного металла, такого как железо или никель. Это позволяет снизить энергозатраты и повысить производительность процесса.
В электронной промышленности определение активного металла помогает выбрать материалы для изготовления электродов и контактных площадок. Например, металлы с высокой электропроводностью, такие как медь или алюминий, часто используются в проводниках и контактах различных устройств. Знание электронной конфигурации активного металла позволяет определить его электропроводность и подходящие условия эксплуатации.
В металлургии, определение активного металла позволяет выбрать подходящий материал для производства структурных компонентов. Металлы с высокой прочностью и стойкостью к коррозии, такие как нержавеющая сталь или титан, широко применяются в авиационной и морской промышленности. Знание электронной конфигурации активного металла помогает выбрать наиболее подходящий материал для конкретного применения.
Определение активного металла по электронной конфигурации играет важную роль в различных областях науки и промышленности. Правильный выбор активного металла позволяет повысить эффективность процессов и улучшить качество конечного продукта. Поэтому, изучение электронной конфигурации металлов и их свойств является неотъемлемой частью современных исследований и технологий.
Вопрос-ответ
Как определить наиболее активный металл по электронной конфигурации?
Наиболее активный металл определяется по его электронной конфигурации, а именно по наличию нескольких валентных электронов во внешней оболочке. У металлов, у которых валентная оболочка либо полностью заполнена, либо полностью пуста, активность обычно ниже. Например, металлы группы 1 (щелочные металлы) имеют один валентный электрон, что делает их очень активными, а металлы группы 18 (благородные газы) имеют полностью заполненную валентную оболочку и являются очень малоактивными.
Как влияет электронная конфигурация на активность металла?
Электронная конфигурация металла определяет его активность. Если металл имеет несколько валентных электронов во внешней оболочке, то он будет более активным, так как он готов отдать эти электроны и образовать положительный ион. Например, щелочные металлы, такие как натрий и калий, имеют один валентный электрон и являются очень активными. С другой стороны, благородные газы, такие как гелий и неон, имеют полностью заполненную валентную оболочку и являются очень малоактивными.
Каковы основные свойства активных металлов?
Активные металлы обладают несколькими основными свойствами. Во-первых, они имеют низкую электроотрицательность, что означает, что они легко отдают электроны другим элементам. Во-вторых, они реагируют с водой и кислородом, что проявляется в их способности образовывать оксиды и гидроксиды. В-третьих, они имеют низкую температуру плавления и кипения, что делает их хорошими проводниками тепла и электричества. И, наконец, активные металлы обычно образуют положительные ионы, когда они реагируют с другими элементами.
