Химическая активность металлов - это способность металла вступать в химические реакции с другими веществами. Она зависит от множества факторов, включая структуру атома, наличие свободных электронов, внешнюю оболочку атома и его энергетику. Кроме того, химическая активность металлов может варьироваться по периоду в таблице Менделеева.
В периоде таблицы Менделеева металлы располагаются слева, а на их правой стороне находятся неметаллы. С каждым последующим периодом химическая активность металлов уменьшается. Это связано с тем, что внешняя энергетическая оболочка атома металла содержит все больше электронов, что делает его более стабильным и менее склонным к реакциям.
Наиболее активные металлы располагаются в левой части таблицы Менделеева. К ним относятся литий (Li), натрий (Na), калий (K) и кальций (Ca). Они легко вступают в реакции с кислородом, хлором и другими неметаллами, образуя оксиды и соли. Металлы, расположенные в центре таблицы Менделеева, такие как железо (Fe) и медь (Cu), имеют более умеренную химическую активность. Они вступают в реакции с кислородом и некоторыми кислотами, но не так быстро, как наиболее активные металлы.
Самыми малоактивными металлами являются металлы из группы платины, такие как платина (Pt) и золото (Au), а также металлы из группы железа, такие как никель (Ni) и цинк (Zn). Они практически не вступают в реакции с кислородом, водой или кислотами. Некоторые из них используются в качестве катализаторов в химических процессах, благодаря своей низкой химической активности и стабильности.
Периодическая таблица химических элементов и их активность
Периодическая таблица химических элементов представляет собой удобную систему классификации всех известных на данный момент элементов. Одной из важнейших характеристик элементов является их химическая активность. Химическая активность определяется способностью элемента взаимодействовать с другими веществами и образовывать химические соединения.
Активность металлов, которые находятся слева от периодической таблицы, увеличивается по мере движения от верхнего левого угла к нижнему правому углу. Верхние металлы, такие как литий и калий, обладают высокой химической активностью и способны реагировать даже с воздухом и водой. Более тяжелые металлы, такие как медь и железо, также активны, но не так сильно, как верхние элементы.
Активность неметаллов, находящихся справа от периодической таблицы, также возрастает по мере движения от верхнего правого угла к нижнему левому углу. Кислород, который находится в верхнем правом углу, является одним из самых активных неметаллов. Вода и многие органические вещества реагируют с кислородом, что приводит к окислению. Хлор, который находится в нижнем левом углу, также является очень активным неметаллом.
Изменение химической активности металлов и неметаллов по периоду обусловлено изменением электроотрицательности элементов. Электроотрицательность характеризует способность атома притягивать электроны к себе. Чем больше электроотрицательность элемента, тем большую роль он играет в реакциях с другими элементами. Поэтому, элементы с большей электроотрицательностью обладают большей химической активностью.
Таким образом, периодическая таблица химических элементов является важным инструментом для изучения и понимания закономерностей химической активности элементов. Зная расположение элементов в таблице, можно делать предположения о том, как они будут реагировать с другими веществами и какие соединения они могут образовывать.
Химическая активность металлов: общие понятия
Химическая активность металлов является одним из ключевых свойств, определяющих их реакционную способность. Металлы в химических реакциях стремятся отдавать свои электроны другим веществам, что свидетельствует о высокой электроотрицательности. Это позволяет металлам активно участвовать в различных процессах окисления и восстановления.
Химическая активность металлов зависит от их положения в периодической таблице. Общая тенденция заключается в том, что активность металлов увеличивается по мере движения от левого к правому на периоде.
Наиболее активные металлы расположены на левой стороне периодической таблицы. Они легко реагируют с кислородом, водой и кислотами, выделяя водород и образуя соли. Примерами таких металлов являются литий, натрий, калий. Они относятся к группе щелочных металлов.
Следующая группа металлов уже менее активна. Они могут реагировать с кислородом, водой и кислотами, но в более ограниченной форме. Представителями таких металлов являются медь, железо, цинк.
Самая низкая активность характерна для металлов, расположенных справа от периодической таблицы. Они практически не реагируют с кислородом, водой и кислотами. Такие металлы, как золото, серебро, платина, известны своей стойкостью и инертностью.
Активность щелочных металлов в периоде
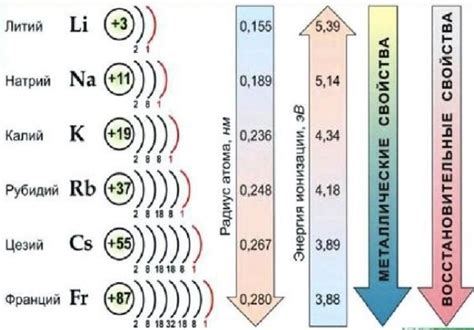
Щелочные металлы – это элементы первой группы периодической системы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы характеризуются высокой химической активностью и наличием одной валентной электронной оболочки.
Активность щелочных металлов в периоде постепенно увеличивается в результате увеличения заряда ядра атома. Литий, наименьший представитель группы, обладает наибольшей активностью. Это связано с малым размером атома и сильным притяжением его положительного ядра к внешней электронной оболочке.
Натрий, калий, рубидий и цезий имеют больший размер атома по сравнению с литием, поэтому они менее активны. Однако, они все равно являются активными металлами и реагируют с водой, кислородом и другими веществами.
Франций, самый тяжелый и большой представитель группы, является наиболее реакционным. Он также обладает наименьшей устойчивостью из всех щелочных металлов, так как его атомный радиус значительно больше и его валентная электронная оболочка слабо связана с ядром.
Таким образом, активность щелочных металлов в периоде возрастает от лития до франция, причем литий является наиболее активным элементом, а франций – наименее устойчивым и реакционным.
Активность щелочноземельных металлов в периоде
Щелочноземельные металлы представлены второй группой периодической системы элементов и включают в себя бериллий, магний, кальций, стронций, барий и радий. Эти элементы обладают высокой химической активностью и встречаются в различных природных материалах. Активность щелочноземельных металлов в периоде претерпевает изменения, что сопряжено с возрастанием электронной конфигурации.
На самом первом месте по активности находится бериллий. Он обладает высокой степенью ковкости и плохо растворяется в воде и растворах кислот. Бериллий осуществляет активные взаимодействия со взвешенными окислительными сероводородными соединениями, а также с токсическими веществами, такими как фосген и флюориды.
Магний, находящийся на следующем месте, обладает высокой способностью образовывать металлические сплавы. Он активно взаимодействует с кислородом, образуя оксид, а также сплавляется с многими металлами. Магниевые соединения широко используются в производстве магниевых сплавов и в качестве компонентов в лекарственных и пищевых препаратах.
Кальций является химически активным щелочноземельным металлом, который растворяется в воде с образованием щелочных гидроксидов. Он служит чрезвычайно важным элементом в организме человека, участвуя в образовании костей и зубов, а также выполняет важную роль в клеточных процессах и нервной системе.
Стронций следует за кальцием в периоде. Он обладает активной химической реакцией с водой, позволяющей получать щелочные гидроксиды. Стронциевые соединения широко применяются в различных отраслях, включая производство огнетушителей, стекла и фармацевтической промышленности.
Барий проявляет высокую степень химической активности и растворяется в воде с образованием щелочного гидроксида. Барийсодержащие соединения применяются в производстве красителей, стекла и катодических материалов для электронных приборов, а также применяются в медицине для рентгенологических исследований.
На последнем месте по активности находится радий. Этот элемент является самым редким и радиоактивным из щелочноземельных металлов. Радий имеет очень короткое время полураспада и образует только радиоактивные изотопы. Его соединения также обладают радиоактивными свойствами.
Активность переходных металлов в периоде

Периодическая система химических элементов позволяет нам видеть закономерности в свойствах элементов в различных периодах. Переходные металлы, находящиеся в периоде, также проявляют определенные особенности своей химической активности.
Изменение активности переходных металлов в периоде связано с изменением электронной конфигурации атома. В начале периода наиболее активными обычно являются металлы с одним или двумя электронами в внешней энергетической оболочке. Они легче отдавать эти электроны и образовывать положительные ионы. Примером такого элемента является литий.
Следующие элементы периода обычно имеют более сложную электронную конфигурацию и более высокую энергию ионизации. Они менее активны и имеют большую способность образовывать соединения со степенями окисления, отличными от стандартных. Это относится, например, к элементам таким, как никель и железо.
В конце периода находятся переходные металлы с полностью заполненными энергетическими оболочками. Они обычно имеют наиболее высокие энергии ионизации и наименьшую способность образовывать соединения. Примерами таких элементов являются меди и цинка.
Активность полуметаллов в периоде
Периодическая таблица химических элементов показывает, что полуметаллами являются элементы, находящиеся между металлами и неметаллами. В периоде полуметаллы располагаются между металлами и неметаллами, и характеризуются своеобразной химической активностью.
В периоде активность полуметаллов постепенно увеличивается, достигает максимума и затем снижается. Например, бериллий (Be), оказывается самым активным полуметаллом в периоде второго периода, благодаря малой электроотрицательности и малому радиусу иона. Он легко реагирует с кислородом, образуя оксид нерасстворимый в воде и растворимый в кислотах.
Далее, активность полуметаллов в периоде постепенно снижается. Антимоний (Sb) и мышьяк (As) располагаются в верхней части периода и имеют среднюю активность. Они способны образовывать кислотные оксиды и соляные соединения.
Активность полуметаллов в периоде зависит от электроотрицательности ионов. По мере приближения к неметаллам в периоде, полуметаллы становятся более активными, так как увеличивается разница в электроотрицательности полуметаллов и кислорода, что способствует более сильным химическим реакциям.
В целом, активность полуметаллов в периоде имеет определенную систематику и связана с их положением в периодической таблице. Это свойство полуметаллов определяет их поведение и возможности использования в различных химических процессах и промышленности.
Активность неметаллов в периоде

Неметаллы представлены в периоде преимущественно чередующимися атомами из групп 14-17. В зависимости от положения неметалла в периоде, их химическая активность может варьироваться.
Первым элементом неметалла в каждом периоде является гидроген (Н), который обладает очень высокой химической активностью, особенно в сочетании с металлами. Он легко реагирует с большинством элементов, образуя соединения, такие как вода (Н2О) и аммиак (NH3).
Вторым неметаллом в периоде является гелий (Не), который обладает очень низкой химической активностью. Его внешняя электронная оболочка полностью заполнена, что делает его стабильным и малоактивным. Это объясняет его отсутствие реакций с другими элементами.
Остальные неметаллы в периоде, такие как кислород (O), фтор (F) и хлор (Cl), обладают разной степенью химической активности. Кислород является вторым по активности неметаллом после гидрогена и способен образовывать с металлами оксиды. Фтор и хлор обладают большей химической активностью и легко взаимодействуют с другими элементами.
Таким образом, активность неметаллов в периоде меняется в зависимости от их положения и электронной конфигурации. Это позволяет элементам проявлять различную реакционную способность и образовывать разнообразные соединения с другими элементами.
Вопрос-ответ
Почему химическая активность металлов изменяется по периоду?
Химическая активность металлов изменяется по периоду из-за изменения электроотрицательности элементов и различной способности металлов отдавать или принимать электроны.
Какие факторы оказывают влияние на химическую активность металлов?
Химическую активность металлов определяют различные факторы, такие как электроотрицательность элемента, размер и структура атома, наличие свободных электронов в валентной оболочке и другие.
Как изменяется химическая активность металлов на протяжении периода?
На протяжении периода химическая активность металлов обычно уменьшается, так как электроотрицательность элементов увеличивается, а способность металлов отдавать электроны уменьшается.
Почему химическая активность металлов уменьшается на протяжении периода?
Химическая активность металлов уменьшается на протяжении периода из-за увеличения электроотрицательности элементов и уменьшения их способности отдавать электроны.
Какие металлы обладают самой высокой химической активностью в своем периоде?
В каждом периоде самой высокой химической активностью обладает металл, находящийся в левой части периодической системы, ближе всего к группе щелочных металлов. Например, во втором периоде это литий, в третьем - натрий, в четвертом - калий.
Почему металлы левой части периодической системы обладают более высокой химической активностью?
Металлы левой части периодической системы обладают более высокой химической активностью, потому что они имеют меньшую электроотрицательность и большую способность отдавать электроны, что делает их более реакционноспособными.
Влияет ли размер атома на химическую активность металлов по периоду?
Размер атома металла также оказывает влияние на его химическую активность. Обычно с увеличением периода размер атома увеличивается, что приводит к уменьшению химической активности металла.
