Гальванические пары металлов являются одной из важных тем при изучении электрохимии. Они представляют собой сочетание двух различных металлов, которые, находясь в электролите, образуют гальваническую ячейку. Основной параметр, определяющий свойства гальванической пары, это тенденция металла к окислению или восстановлению. Таблица ГОСТ 10704-91 является стандартной классификацией гальванических пар металлов, которая используется в области электрохимии и гальванизации.
Таблица ГОСТ 10704-91 содержит информацию о различных металлах и их сочетаниях при образовании гальванических пар. Металлы классифицируются в зависимости от их потенциала окисления и восстановления. Они могут быть разделены на несколько групп в зависимости от своей электрохимической активности. Таблица позволяет определить, какие металлы можно сочетать в гальванической паре для достижения определенных электрохимических процессов, например, гальванической золочения или покрытия.
Таблица ГОСТ 10704-91 является важным руководством для профессионалов в области гальванизации и электрохимии. Она помогает разработать оптимальные гальванические пары металлов для различных процессов, обеспечивая эффективность и качество гальванического покрытия. Она также позволяет избежать нежелательных побочных эффектов, таких как коррозия или окисление.
Значение гальванических пар металлов

Гальванические пары металлов играют важную роль в электрохимических процессах и имеют широкое применение в различных отраслях промышленности. Значение гальванических пар металлов определяется их электропотенциалом и позволяет предсказать возможность и направление течения электрического тока при их взаимодействии.
Каждая гальваническая пара металлов имеет свой порядок электропотенциалов, который отражает их способность отдавать или принимать электроны. По убыванию электропотенциалов металлы в таблице ранжируются отрицательным зарядом к положительному. В результате гальванической пары металлы делятся на две группы – активные и пассивные.
Активные металлы обладают более низким электропотенциалом и находятся на левой стороне таблицы гальванической серии. Они выступают в роли анода и при контакте с пассивным металлом позволяют осуществлять катодный защитный электролиз, предотвращая коррозию более пассивного металла.
Пассивные металлы, имеющие более высокий электропотенциал, находятся на правой стороне таблицы гальванической серии. Они выступают в роли катода и при контакте с активными металлами обеспечивают защиту от коррозии путем поглощения электронов и кислорода из окружающей среды.
Знание значений гальванических пар металлов позволяет правильно выбирать материалы, проводить гальваническую обработку и защиту от коррозии, а также предсказывать и контролировать ход электрохимических процессов.
Таблица ГОСТ 10704-91 и ее роль
Таблица ГОСТ 10704-91 является стандартом, разработанным Государственным комитетом по стандартизации СССР, и используется для определения гальванической активности металлов и их сплавов.
Роль таблицы заключается в том, что она предоставляет информацию о различных гальванических парах металлов и влиянии их соединения на электрохимическую реакцию. В нашей таблице приведены основные элементы, для которых указаны их электрические потенциалы или потенциалы коррозии в заданных условиях.
Используя таблицу ГОСТ 10704-91, можно определить, какие пары металлов могут быть использованы вместе без вредного воздействия друг на друга, а какие металлы не рекомендуется комбинировать в соответствии с их электрохимическими свойствами.
Также таблица ГОСТ 10704-91 помогает в выборе правильного металла или сплава для конкретного применения, учитывая его электрическую активность в сочетании с другими материалами.
Знание и использование таблицы ГОСТ 10704-91 позволяет эффективно предотвратить коррозию металлов, уменьшить износ материалов и обеспечить надежную работу технических систем и конструкций.
Влияние гальванических пар на их химические свойства

Гальванические пары металлов имеют значительное влияние на их химические свойства. Они образуются при контакте различных металлов между собой, и это приводит к возникновению электрохимической реакции.
Главным фактором, влияющим на химические свойства гальванических пар, является разность потенциалов между металлами. Чем больше разница в потенциале, тем более активный металл будет действовать как анод, а менее активный - как катод. При этом анодные металлы будут активно окисляться, а катодные металлы будут восстанавливаться.
Такое взаимодействие между металлами может приводить к коррозии и даже разрушению материалов. В данном случае, металл с большей электрохимической активностью будет подвергаться коррозии, а металл с меньшей активностью будет оставаться стабильным и не будет подвергаться химическому воздействию.
Гальванические пары металлов могут также влиять на скорость реакций, протекающих в системе. Если металлы обладают большой разностью потенциалов и активностью, то это может привести к ускорению реакций окисления и восстановления.
Таким образом, гальванические пары металлов имеют важное значение не только для электрохимических процессов, но и для химических свойств самих металлов. Изучение этих пар позволяет более точно предсказывать и контролировать их поведение в различных условиях и применять их с учетом их взаимодействия в конкретных системах.
Функциональное назначение гальванических пар металлов
Гальванические пары металлов широко используются в различных областях науки и техники. Они основываются на принципе электрохимической реакции, которая происходит между двумя разными металлами, погруженными в электролитическую среду.
Одно из основных функциональных назначений гальванических пар металлов - получение электрической энергии. При соединении двух разных металлов в электролитической среде происходит движение электронов от одного металла к другому, что приводит к возникновению разности потенциалов и, как следствие, к генерации электрической энергии.
Кроме того, гальванические пары металлов используются для создания защитных покрытий на металлических поверхностях. Некоторые металлы имеют большую электрическую потенциальную разность и более активны в реакциях окисления и восстановления. Используя эту особенность, можно создать покрытие из одного металла на поверхности другого, тем самым защищая его от коррозии и других негативных воздействий окружающей среды.
Также гальванические пары металлов находят применение в области электрохимического анализа. Они позволяют определить содержание определенных веществ в растворах по изменению потенциала, образующемуся при различных сочетаниях металлов. Это позволяет проводить качественный и количественный анализ веществ и растворов.
Таким образом, гальванические пары металлов имеют широкий спектр применения и выполняют различные функции. Они используются для получения электрической энергии, создания защитных покрытий и проведения электрохимического анализа. Комбинируя различные металлы и электролитические среды, можно добиться различных электрохимических реакций и получать необходимые результаты в различных областях науки и промышленности.
Применение таблицы ГОСТ 10704-91 в промышленности
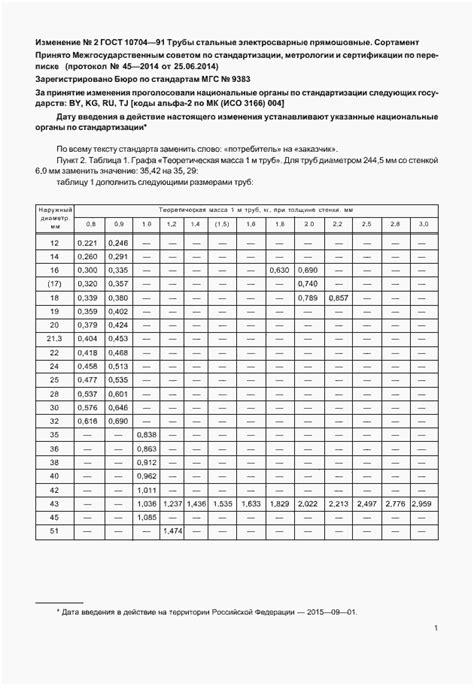
Таблица ГОСТ 10704-91 является важным инструментом для промышленности, особенно для производителей металлических изделий. Она представляет собой систематизированный список гальванических пар металлов, который позволяет определить исходные данные для проведения электрохимических процессов в промышленности.
Одним из основных применений таблицы ГОСТ 10704-91 является выбор подходящей комбинации металлов для создания гальванической пары. Это позволяет регулировать химические реакции, происходящие на поверхности металлических изделий, например, при гальванизации. В результате правильного выбора гальванической пары можно достичь более стойких и долговечных покрытий.
Также таблица ГОСТ 10704-91 используется в процессе антикоррозионной защиты металлических конструкций. На основе данных таблицы можно определить, какие металлы склонны к электрохимической коррозии при контакте с определенными средами. Это помогает выбрать правильные материалы для создания конструкций, которые будут выдерживать агрессивные условия эксплуатации без повреждений.
Таблица ГОСТ 10704-91 также полезна при проведении исследований в области электрохимии. Она позволяет установить зависимости между различными параметрами, такими как разность потенциалов и температура, и предсказывать результаты электрохимических реакций. Это помогает улучшить эффективность процессов, связанных с преобразованием электрической энергии в химическую и наоборот.
Вопрос-ответ
Какие металлы входят в таблицу ГОСТ 10704-91?
В таблицу ГОСТ 10704-91 входят металлы, относящиеся к первой и второй группам, такие как железо, цинк, алюминий, медь, свинец, никель и другие.
Зачем нужна таблица гальванических пар металлов?
Таблица гальванических пар металлов помогает определить, какие металлы можно использовать в паре между собой без риска для коррозии или других нежелательных процессов.
Какие факторы влияют на гальваническую активность металлов?
На гальваническую активность металлов влияют их электрохимические свойства, концентрация ионов в растворе, температура, а также наличие примесей и другие факторы.
Какие металлы являются самыми активными в таблице гальванических пар?
Самыми активными металлами в таблице гальванических пар являются алюминий и цинк. Они способны выступать в роли анода и активно реагировать с окружающей средой.
Как определить, какой металл будет действовать как анод в гальванической паре?
Металл, который имеет более отрицательный потенциал окисления в таблице гальванических пар, будет действовать как анод и терять электроны при гальванической реакции.
Можно ли использовать металлы разных групп в гальванической паре?
Да, можно использовать металлы разных групп в гальванической паре, но это может привести к коррозии более активного металла. Поэтому рекомендуется использовать металлы из одной группы для предотвращения коррозии.
Что такое потенциал окисления металла?
Потенциал окисления металла - это мера его способности отдавать электроны в реакции окисления. Чем более положительный потенциал окисления металла, тем больше его способность отдавать электроны.
