Гальваническая пара - это электрохимическая система, в которой два различных металла находятся в контакте друг с другом и средой, содержащей ионы. В такой системе каждый металл обладает разной электрохимической активностью, что вызывает возникновение потенциалов и движение электронов.
Действие гальванической пары основано на принципе окислительно-восстановительных реакций. Один из металлов, называемый анодом, окисляется, отдавая свои электроны, которые перемещаются по цепи к другому металлу, называемому катодом. На катоде происходит восстановление, при этом электроны переходят на металл. Таким образом, гальваническая пара создает электрический ток, который можно использовать в различных целях.
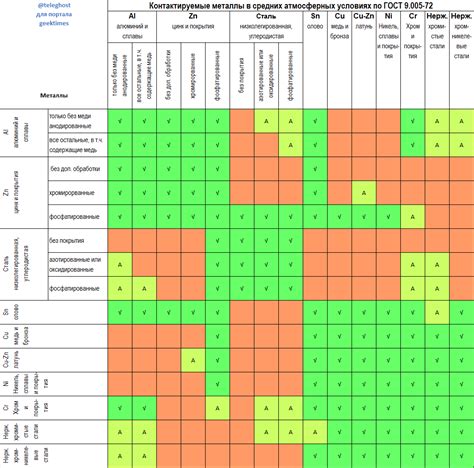
Для того чтобы гальваническая пара металлов функционировала, важно выбирать сочетание металлов с разными электрохимическими свойствами. Например, пара цинка и меди является одной из самых распространенных гальванических пар. В такой паре цинк выполняет роль анода, так как он имеет большую электрохимическую активность и легко окисляется. Медь же является катодом, так как окисление на ней медленное, и медь восстанавливается. Наличие электролита, содержащего ионы, позволяет проводить электроны между металлами и создать электрическую цепь.
Гальваническая пара металлов: принцип работы и свойства
Гальваническая пара металлов – это физико-химическая система, в которой два различных металла контактируют друг с другом в электролите. Пара состоит из анодного и катодного металлов, которые имеют разный потенциал электродов.
Основной принцип работы гальванической пары заключается в том, что из-за разных потенциалов металлов электроны переносятся от одного металла к другому через электролит, создавая электрическую цепь. При этом, металл с более высоким потенциалом становится катодом, а металл с более низким потенциалом – анодом.
Гальваническая пара металлов обладает следующими свойствами:
- Электродный потенциал – основной параметр, определяющий показатели пары. Он зависит от химических свойств металлов и состояния электролита.
- Коррозионная активность – возможность металлов участвовать в реакциях окисления и восстановления, что приводит к коррозии. Коррозионная активность может быть увеличена или уменьшена взаимодействием с другим металлом в гальванической паре.
- Происхождение электродного потенциала – его величина зависит от ряда напряжений между различными полупроводниками, связанными с реакциями окисления и восстановления.
- Использование в практике – гальваническая пара металлов находит широкое применение: от использования в гальванических элементах и аккумуляторах до создания гальванического покрытия и защиты металлов от коррозии.
Основные понятия гальванической пары
Гальваническая пара - это электрохимическая система, состоящая из двух различных металлов, соединенных электролитом. В такой паре происходит перенос электронов и ионов между металлами, что вызывает электрическую разницу потенциалов и электролитические реакции.
Электрод - это металлический проводник, который представляет собой один из элементов гальванической пары. В паре существуют два электрода: анод и катод.
Анод - это положительно заряженный электрод, на котором происходит окисление (потеря электронов).
Катод - это отрицательно заряженный электрод, на котором происходит восстановление (прием электронов).
Электролит - это раствор или плавленная смесь веществ, которая служит для проведения электрического тока между электродами. Электролит может быть кислотным, щелочным или солевым.
Гальванический элемент - это устройство, состоящее из гальванической пары и соединяющих их электродов. Он способен преобразовывать химическую энергию в электрическую. Примером гальванического элемента является гальваническая батарея.
Принцип работы гальванической пары
Гальваническая пара представляет собой электрохимическую систему, в которой два различных металла контактируют между собой и взаимодействуют с раствором электролита. Принцип работы гальванической пары основан на разности электрохимического потенциала металлов, которая приводит к запуску процесса электролиза.
Когда два различных металла погружаются в электролит, между ними возникает градиент электродного потенциала. Электролит растворяет ионные формы металлов, и между атомами металлов и ионами в электролите устанавливаются различные потенциалы.
В результате разности потенциалов между двумя контактирующими металлами и электролитом, металл с более высоким потенциалом (анод) начинает окисляться, отдавая свои электроны электролиту. Электроны постоянно движутся от анода в сторону металла с более низким потенциалом (катод), создавая ток.
Этот ток может использоваться для питания электрических устройств или выполнять электролизные реакции, например, в процессе электрохимического осаждения металлов на поверхность другого металла (гальванизация).
Химические свойства гальванической пары
Гальваническая пара представляет собой систему из двух различных металлов или сплавов, которые находятся в контакте друг с другом в присутствии электролита. Взаимодействие этих металлов происходит на электрохимическом уровне, что приводит к возникновению электрического потенциала между ними.
Одно из химических свойств гальванической пары - образование электродов различных знаков. При образовании пары один металл становится анодом, другой - катодом. Анод - это область, где происходит окисление металла и выделение электронов, катод - область, где происходит восстановление металла и поглощение электронов.
Кроме того, гальваническая пара обладает способностью к реакциям окисления-восстановления. В процессе работы пары происходит передача электронов от анода к катоду по внешней цепи, что сопровождается разнообразными реакциями окисления и восстановления в электролите. Это позволяет использовать гальваническую пару для получения электрической энергии или для преобразования химической энергии в электрическую.
Изучение химических свойств гальванической пары позволяет понять, какие процессы протекают на электроде каждого металла, каковы их скорости и как связаны эти процессы с потенциалом пары. Понимание этих свойств позволяет оптимизировать работу гальванической пары и использовать ее в различных областях, например, в производстве батарей или коррозионной защите металлических конструкций.
Физические свойства гальванической пары

Гальваническая пара – это система, включающая два разных металла, находящихся в электролите и связанных электрической цепью. Когда эти металлы имеют различные электрохимические потенциалы, они образуют гальваническую пару, которая способна генерировать электрический ток.
Свойства гальванической пары зависят от физических характеристик металлов, а именно их проводимости, электропроводности и плотности. Металлы, образующие пару, должны быть проводниками электричества, чтобы электроны могли свободно перемещаться между ними внутри электролита. Более высокая проводимость металлов позволяет обеспечить более эффективный токопровод.
Плотность металлов также играет роль в свойствах гальванической пары. Материалы с высокой плотностью, такие как медь или серебро, имеют более высокую электрическую проводимость и могут быть более эффективными в создании пары. Однако, более плотные материалы могут быть и более тяжелыми, что может влиять на удобство и применимость гальванической пары в различных областях.
Еще одним важным физическим свойством гальванической пары является электропроводность металлов. Она определяет способность металлов передавать электрический ток. Металлы с более высокой электропроводностью могут облегчать процесс передачи тока в гальванической паре и, следовательно, способствовать более эффективной работе связанных устройств и систем.
Применение гальванической пары в практике
Гальваническая пара металлов активно применяется в практике в различных областях, особенно в электрохимии и электротехнике. Ее основное применение связано с использованием действия электролитов на металлы и с возможностью получать электрический ток путем протекания электрохимических реакций.
Одним из основных применений гальванической пары является создание первичных и вторичных источников электрического тока, таких как батарейки. В первичных источниках электрохимические реакции происходят однократно, после чего батарейка выбрасывается. Вторичные источники, например, аккумуляторы, позволяют многократно заряжаться и разряжаться.
Гальваническая пара используется также в гальванотехнике для проведения электролиза: металлы наносятся на поверхности изделий, используя гальванический метод. Он применяется в гальванопластике для получения тонких и ровных покрытий на металлических предметах, таких как ювелирные изделия, автомобильные детали и т. д.
Другим применением гальванической пары металлов является защита от коррозии. Она применяется в методе катодной защиты, где намеренно создаются гальванические пары для защиты металлов от коррозии. В этом методе пассивный металл (катод) соединяется с активным металлом (анодом) через электролит. Анолит постепенно разрушается при помощи коррозии, защищая пассивный металл от повреждений.
Таким образом, гальваническая пара металлов является важным инструментом в практике, позволяющим получать электрический ток, проводить гальванотехнику и защищать металлы от коррозии.
Преимущества и недостатки использования гальванической пары

Преимущества:
- Большое разнообразие гальванических пар металлов позволяет выбирать комбинацию, которая подходит для конкретных требований и условий.
- Гальваническая пара используется для создания защитной покрытий на металлических поверхностях, что повышает их стойкость к коррозии.
- Электродные потенциалы различных металлов позволяют использовать гальваническую пару для производства электрической энергии в гальванических элементах и аккумуляторах.
- Гальваническая пара может использоваться для удаления окислов и загрязнений с поверхностей металлов.
- Использование гальванической пары не требует сложной технической оснастки и может быть реализовано в домашних условиях.
Недостатки:
- В процессе работы гальванической пары могут возникать коррозионные процессы на наименее благоприятных металлах.
- Эффективность гальванической пары может быть снижена из-за различных факторов, таких как плохой контакт между металлами или наличие загрязнений на поверхностях.
- Длительное использование гальванической пары может привести к износу и повреждению электродов.
- Создание и поддержание гальванической пары требует определенной экспертизы и знаний в области электрохимии.
- Некоторые металлы могут быть токсичными или вызывать аллергические реакции, что может ограничить их использование при создании гальванической пары.
Примеры гальванических пар металлов
Гальваническая пара металлов - это электрохимическая система, состоящая из двух различных металлов, которые окисляются и восстанавливаются во время химической реакции. В результате этой реакции возникает разность потенциалов, что позволяет использовать гальваническую пару для производства электрического тока.
Примером гальванической пары может быть сочетание меди и цинка. При контакте этих двух металлов в присутствии электролита, например, соли цинка, между ними возникает разность потенциалов. В результате цинк будет окисляться, а медь будет восстанавливаться. Это позволяет использовать такую гальваническую пару для получения электрического тока.
Еще одним примером гальванической пары металлов является алюминий и железо. При контакте этих металлов в присутствии электролита, например, соли алюминия, возникает разность потенциала, которая приводит к окислению железа и восстановлению алюминия. Такая гальваническая пара может быть использована для производства электрической энергии.
Существует множество других комбинаций металлов, которые могут образовывать гальванические пары. Некоторые из них включают: медь и железо, серебро и цинк, золото и алюминий. Каждая пара имеет свою уникальную электрохимическую активность и может быть использована в различных целях, от производства электрической энергии до защиты металлов от коррозии.
Вопрос-ответ
Что такое гальваническая пара металлов?
Гальваническая пара металлов - это система, в которой два различных металла контактируют с электролитом, образуя потенциалы разного знака, что приводит к возникновению электродвижущей силы
Какая роль электролита в гальванической паре?
Электролит играет роль проводника для ионов, которые перемещаются между металлическими электродами. Он содержит растворенные ионы, которые при контакте с металлами вызывают окислительно-восстановительные реакции и создают разность потенциалов
Какие металлы могут образовывать гальваническую пару?
Практически любые два металла могут образовывать гальваническую пару. Однако, для эффективной работы гальванической пары необходимо выбирать металлы с разной электрохимической активностью. Например, цинк и медь, железо и алюминий и т.д.
Как гальваническая пара влияет на коррозию металлов?
Гальваническая пара может усилить коррозию одного из металлов, так как при контакте металлов и наличии электролита возникает катодно-анодная реакция. При этом, активный металл (анод), который находится в паре с менее активным (катод), начинает распадаться, а катодная область металла будет долее защищена от коррозии
Какие применения имеет гальваническая пара металлов?
Гальваническая пара металлов находит применение во многих областях, таких как производство электрохимических элементов (батарей), гальваническое покрытие металлами, электролиз и т.д. Также гальваническая пара используется в электрохимических процессах, таких как гальванический элемент и аккумулятор.
