Электронная конфигурация металла отражает расположение его электронов в энергетических уровнях и подуровнях атома. В данной статье мы рассмотрим электронную конфигурацию металла, которая задается следующей последовательностью энергетических уровней и подуровней: 1s2 2s2 2s22p2 2s22p4.
Первый энергетический уровень (K-уровень) содержит 2 электрона, расположенных на одном s-подуровне. Второй энергетический уровень (L-уровень) также содержит 2 электрона, распределенных между s- и p-подуровнями. Таким образом, суммарно на первых двух уровнях содержится 4 электрона.
На третьем энергетическом уровне (M-уровень) располагается еще один s-подуровень, на котором находятся 2 электрона. Кроме того, на этом уровне имеется p-подуровень, на котором находятся еще 4 электрона. Итого на M-уровне содержится 6 электронов. Такая электронная конфигурация металла указывает на его химические свойства и способность образовывать ионы с определенными зарядами.
Выводя общую электронную конфигурацию металла: 1s2 2s2 2s22p2 2s22p4, можно сделать вывод, что наиболее заполненными энергетическими уровнями являются первые два (K- и L-уровни), которые содержат 4 электрона. Следующий по заполненности энергетический уровень – M-уровень, содержащий 6 электронов. Таким образом, электронная конфигурация указанного металла говорит о его электронной структуре и определяет его свойства и взаимодействие с другими веществами.
Сущность электронной конфигурации металла
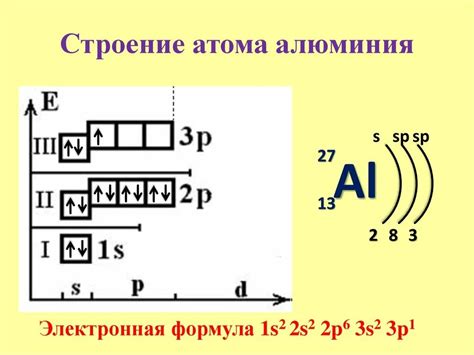
Электронная конфигурация металла определяет распределение электронов в его энергетических уровнях и субуровнях. Она является важной характеристикой металла, так как определяет его химические и физические свойства.
Атомы металлов имеют относительно небольшое количество электронов в своей внешней оболочке. Под внешней оболочкой понимается самый высокий энергетический уровень, на котором находятся электроны. Обычно внешняя оболочка содержит от одного до трех электронов.
Электроны в металлах могут перемещаться свободно по всей структуре кристалла, что позволяет им обладать хорошей проводимостью электричества и тепла. Также электроны могут быть легко переданы из одного атома металла другим, что позволяет металлам проявлять химическую активность и образовывать соединения.
Электронная конфигурация металла также влияет на его способность образовывать ионы. Металлы обычно образуют положительно заряженные ионы путем отдачи одного или нескольких электронов из внешней оболочки. Это объясняет их способность образовывать ионы с различными зарядами.
Изучение электронной конфигурации металла позволяет более глубоко понять его химические свойства и способность к реакциям. Кроме того, знание электронной конфигурации металла может быть использовано для предсказания его поведения в определенных химических ситуациях.
Структура электронной оболочки металла
Металлы представляют собой класс веществ, характеризующихся определенными физическими и химическими свойствами. Их основными особенностями являются прочность, электропроводность и термическая проводимость. Одной из причин таких свойств металлов является структура их электронной оболочки.
Электронная конфигурация металлов может быть представлена последовательностью оболочек и подоболочек, заполненных электронами. Например, электронная конфигурация металла, представленная как "1s2 2s2 2s22p2 2s22p4", указывает на наличие электронов в различных подуровнях энергии.
Подуровени энергии включают s-подуровень, p-подуровень, d-подуровень и f-подуровень. В этих подуровнях энергии могут находиться максимально 2, 6, 10 и 14 электронов соответственно. Поэтому электронная конфигурация металла "1s2 2s2 2s22p2 2s22p4" указывает, что в оболочке металла находится 2 электрона на s-подуровне, 6 электронов на p-подуровне и 4 электрона на s-подуровне.
Структура электронной оболочки металла определяет его химические и физические свойства. Например, металлы обладают высокой электропроводностью, так как их электроны в оболочке легко двигаются. Также структура оболочки металла определяет его способность к образованию соединений с другими элементами.
В целом, электронная конфигурация металла, представленная последовательностью подуровней энергии, играет важную роль в определении свойств металла. Она определяет его электропроводность, прочность и термическую проводимость, а также его способность к химическим реакциям и образованию соединений.
Особенности электронной конфигурации металла
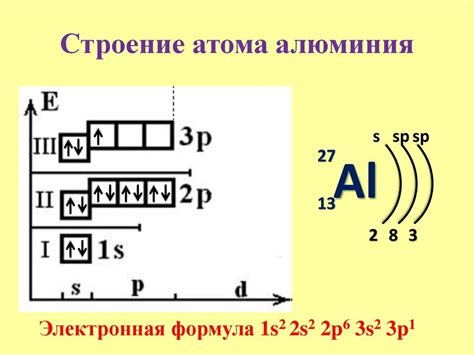
Электронная конфигурация металла 1s2 2s2 2s22p2 2s22p4 является особой и содержит некоторые характерные особенности.
Вначале заметим, что эта конфигурация указывает на присутствие 2 электронов в 1s-орбитали, 2 электронов в 2s-орбитали, 2 электронов в первой попутной паре 2p-орбиталей и 4 электронов во второй паре 2p-орбиталей.
Очевидно, что данный металл содержит внешнюю оболочку с непарными электронами, что делает его весьма реакционноспособным. Наличие непарных электронов позволяет металлу образовывать химические связи и вступать в реакции с другими веществами.
Важно отметить, что электроны находятся на различных энергетических уровнях и орбиталях. Это означает, что они обладают разной энергией и способны участвовать в химических реакциях с различной активностью. Такая разница в энергии электронов позволяет металлу проявлять свои уникальные свойства.
Кроме того, электронная конфигурация металла указывает на его место в периодической таблице элементов. Так, данный металл принадлежит к 2-му периоду и находится в 13-й группе. Это говорит о том, что он обладает определенными химическими свойствами, схожими с другими элементами этой группы, и может образовывать соединения с различными элементами.
Вопрос-ответ
Какая электронная конфигурация этого металла?
Электронная конфигурация этого металла состоит из следующих орбиталей и количества электронов: 1s2 2s2 2s22p2 2s22p4.
Какие орбитали заполнены электронами?
Орбиталь 1s заполнена 2 электронами, орбиталь 2s заполнена 2 электронами, орбиталь 2p заполнена 6 электронами.
Сколько всего электронов в этой электронной конфигурации?
В этой электронной конфигурации всего 10 электронов.
Какие уровни энергии заполнены электронами?
Уровень энергии 1 заполнен 2 электронами, уровень энергии 2 заполнен 8 электронами.
Какие орбитали частично заполнены в этом металле?
В этом металле орбитали 2p частично заполнены, присутствует 4 электрона.
Какие орбитали полностью заполнены в этом металле?
В этом металле орбитали 1s и 2s полностью заполнены, содержат 2 электрона каждая.
Какие орбитали еще не заполнены в этом металле?
В этом металле орбитали 4s, 3d, 4p и последующие пока не заполнены.
