В химии металлы делят на активные и неактивные, в зависимости от уровня их химической активности. Среди всех металлов наименее активным считается металл, у которого наружный электронный слой заполнен полностью или почти полностью. Такие металлы имеют устойчивую электронную конфигурацию и мало реагируют с другими веществами.
Одним из наименее активных металлов является свинец (Pb). Его атом имеет 82 электрона. Электронная конфигурация свинца представляет собой последовательное заполнение энергетических уровней электронами. Первый энергетический уровень заполняется двумя электронами, второй - восьмью, третий - восемью и так далее. Последний энергетический уровень у свинца заполнен 2 электронами s-подуровня и 10 электронами p-подуровня.
Такая электронная конфигурация делает свинец очень устойчивым металлом. Он практически не реагирует с водой или кислородом, что позволяет использовать его для защиты от коррозии. Кроме того, свинец обладает высокой плотностью и плавится при низкой температуре, что делает его полезным материалом в различных инженерных и медицинских приложениях.
Определение электронной конфигурации
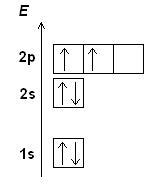
Электронная конфигурация атома представляет собой упорядоченное распределение электронов по основным энергетическим уровням и подуровням в атоме. Она определяет, как электроны распределены вокруг ядра атома и позволяет предсказать его химические свойства.
Изучение электронной конфигурации позволяет понять, как атом взаимодействует с другими атомами и как образуются химические связи. Электронная конфигурация определяется с помощью принципа валентных электронов, принципа заполнения Энергетических уровней и правил ауфбау.
Принцип валентных электронов гласит, что атом стремится иметь заполненную внешнюю оболочку, состоящую из 8 электронов - так называемая "октетная" конфигурация. Для этого атом может отдавать, принимать или делить свои электроны с другими атомами. Основная электронная конфигурация, которая определяет химические свойства элемента, представляет собой распределение его электронов по энергетическим уровням и подуровням.
Существует несколько методов определения электронной конфигурации, включая спектроскопический метод, метод расчета и метод электронного конфигурационного приближения. В результате определения электронной конфигурации можно сделать вывод о химических свойствах вещества и его реакционной способности.
Связь электронной конфигурации с активностью металла
Электронная конфигурация металла определяет его активность и способность вступать в химические реакции. Активность металла зависит от образования и устойчивости его ионов, а также от энергии, необходимой для перехода электрона с валентной оболочки на другие уровни энергии.
Металлы имеют общую особенность - они имеют меньшую валентность, чем неметаллы. Это связано с тем, что атомы металла в основном состоят из симметричных валентных оболочек, имеющих от 1 до 3 электронов. При этом эти электроны слабо прикреплены к ядру и могут легко передаваться другим атомам.
Наименее активные металлы обладают электронной конфигурацией, в которой валентные электроны располагаются на достаточно удаленных оболочках, что затрудняет их участие в химических реакциях. Однако, даже у наименее активных металлов есть свои специфические свойства.
Например, самым наименее активным металлом является иридий. Этот металл имеет электронную конфигурацию [Xe] 4f14 5d7 6s2. У иридия на самых удаленных оболочках находятся всего лишь 2 валентных электрона. Благодаря этому, иридий обладает высокой устойчивостью и редко вступает в реакции с другими веществами.
Таким образом, связь электронной конфигурации с активностью металла является важным аспектом изучения химических свойств и поведения металлов. Это позволяет предсказывать и объяснять их способность вступать в реакции и формировать соединения с другими веществами.
Наименее активный металл и его электронная конфигурация
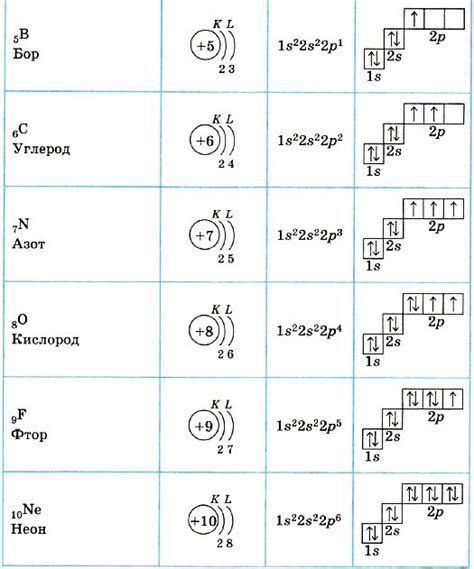
В химии существует множество элементов, каждый из которых обладает своими уникальными свойствами и особенностями. Один из таких элементов - наименее активный металл.
Электронная конфигурация наименее активного металла определяет его химические свойства и способность взаимодействовать с другими элементами. Важно отметить, что активность элемента может быть определена различными способами, такими как реакция с водой, кислородом или кислотами.
Наименее активный металл в периодической системе элементов - гелий. Его электронная конфигурация состоит из двух электронов на внешнем энергетическом уровне. Такая конфигурация делает его стабильным и малоактивным элементом.
Гелий - инертный газ, который не реагирует с другими элементами и обладает высокой стабильностью. Это объясняется его полной валентной оболочкой, которая уже заполнена двумя электронами. Гелий широко применяется в различных областях, таких как аэрокосмическая промышленность, медицина и научные исследования.
Электронная конфигурация гелия, характеризующаяся двумя электронами на внешнем энергетическом уровне, делает его наименее активным металлом. Гелий имеет самую низкую энергию и наименьшую способность к реакциям с другими элементами по сравнению с остальными металлами.
Исследования электронной конфигурации наименее активного металла
Наименее активный металл в периодической системе элементов обращает на себя внимание ученых, так как его электронная конфигурация может иметь особые свойства. Электронная конфигурация определяет распределение электронов по энергетическим уровням в атоме данного металла.
Исследования позволяют установить, какие квантовые состояния электронов существуют в атоме наименее активного металла, и какие взаимодействия происходят между ними. Это помогает понять, почему данный металл проявляет низкую активность при химических реакциях.
Одним из методов исследования электронной конфигурации является спектроскопия. Спектральные характеристики взаимодействия атомов наименее активного металла с электромагнитным излучением позволяют определить энергетические уровни электронов, их переходы при поглощении или испускании фотонов.
Другим методом исследования является использование математических моделей, основанных на квантовой механике. С помощью этих моделей ученые строят атомные орбитали и определяют энергетические уровни электронов в атоме наименее активного металла.
Полученные результаты исследований электронной конфигурации наименее активного металла могут применяться в различных областях науки и техники. Например, они могут быть использованы для создания новых материалов с уникальными свойствами или для разработки более эффективных каталитических систем.
Таким образом, исследования электронной конфигурации наименее активного металла имеют большое значение для понимания его природы и применения в различных областях науки и техники.
Важность понимания электронной конфигурации наименее активного металла
Электронная конфигурация является одной из ключевых характеристик атомов металлов, определяющих их активность и реакционную способность. Особое внимание уделяется электронной конфигурации наименее активных металлов, так как она сильно отличается от активных металлов.
Наименее активные металлы, такие как медь, серебро и золото, имеют характерную электронную конфигурацию, в которой валентная оболочка содержит всего один электрон. Наличие такого единственного электрона делает эти металлы более стабильными и менее склонными к реакциям с другими веществами.
Однако, даже наименее активные металлы могут образовывать химические соединения и участвовать в реакциях. Знание и понимание их электронной конфигурации позволяет объяснить и предсказать их реакционные способности и свойства. Например, именно благодаря электронной конфигурации меди, она проявляет способность образовывать разнообразные оксиды и соли, что находит применение в различных отраслях промышленности и технологии.
Более глубокое понимание электронной конфигурации наименее активного металла позволяет также предсказать его поведение в различных условиях и оптимизировать его использование в разных процессах. Например, зная электронную конфигурацию серебра, можно предположить его большую устойчивость к окислению и использовать его в производстве электроники или в качестве катализатора.
Таким образом, понимание электронной конфигурации наименее активного металла имеет важное практическое значение, позволяющее не только понять его физические и химические свойства, но и эффективно использовать его в различных приложениях и процессах.
Вопрос-ответ
Какая электронная конфигурация является наименее активной у металла?
Наименее активной электронной конфигурацией у металла является полностью заполненная внешняя энергетическая оболочка. Например, у газа инертных металлов, таких как гелий, электронная конфигурация будет 1s^2, где 1s - энергетическая оболочка, а 2 - количество электронов в этой оболочке. Другие примеры металлов со стабильными конфигурациями включают неон (2s^2 2p^6), криптон (3s^2 3p^6 3d^10), ксенон (4s^2 4p^6 4d^10 4f^14), радон (5s^2 5p^6 5d^10 5f^14 6s^2).
Почему полностью заполненная энергетическая оболочка делает металл наименее активным?
Полностью заполненная энергетическая оболочка делает металл наименее активным, потому что это означает, что все электронные уровни в оболочке заняты и электроны этих уровней оказываются стабильными. Когда оболочка заполнена, нет свободных мест для присоединения или отдачи электронов, и металл не проявляет химической активности.
Какие металлы имеют наименее активную электронную конфигурацию?
Металлы с наименее активной электронной конфигурацией включают инертные газы в группе 18 периодической системы, такие как гелий, неон, аргон, криптон, ксенон и радон. Они имеют полностью заполненные электронные оболочки и, как результат, являются наименее химически активными металлами.
Какая электронная конфигурация наименее активного металла в группе 1?
Наиболее близким к наименее активному металлу в группе 1 периодической системы является металл группы 18 - гелий. Электронная конфигурация гелия: 1s^2, где 1s - энергетическая оболочка, а 2 - количество электронов в этой оболочке.
