Электролиз водного раствора нитрата меди II – это процесс, при котором происходит выделение металла на катоде. Этот процесс происходит при наличии постоянного электрического тока, соединенного соответствующим образом с двумя электродами, известными как анод и катод.
Катод – это электрод, на котором происходит редукция, то есть выделение металла. В данном случае, на катоде выделяется медь. Анод же служит для окисления, в данном случае окисление катионов меди II. Во время электролиза, катионы меди II перемещаются водным раствором к катоду, где они принимают электроны и превращаются в нейтральную медь.
Для успешного проведения электролиза водного раствора нитрата меди II необходимы определенные условия. Сначала необходимо выбрать правильные электроды, в данном случае это медный анод и медный катод. Затем нужно создать постоянное электрическое поле, подключив источник электричества к электродам. Кроме того, также важно подобрать правильное напряжение и силу тока, чтобы процесс происходил эффективно и безопасно.
Процесс электролиза
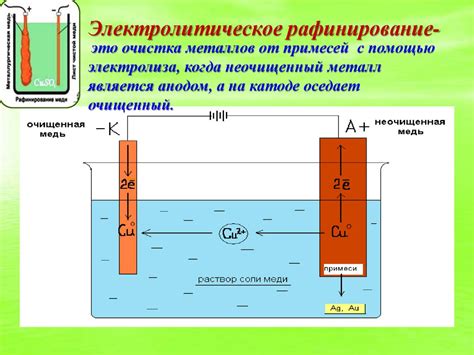
Электролиз - это процесс химического разложения вещества под воздействием электрического тока. Он применяется в различных областях, включая производство металлов. Одним из примеров электролиза является выделение металла на катоде при электролизе водного раствора нитрата меди II.
Для проведения электролиза необходимы анод и катод, которые погружаются в электролит - вещество, способное проводить электричество. В случае электролиза водного раствора нитрата меди II в качестве анода используется медная пластина, а в качестве катода - другая металлическая пластина.
При подаче постоянного тока между анодом и катодом начинается процесс разложения раствора. Вода на аноде окисляется, выделяется кислород и образуется окись меди (II). Эти реакции происходят с участием электронов, которые перемещаются через электролит от анода к катоду.
На катоде происходит обратная реакция - происходит восстановление окиси меди (II). Этот процесс сопровождается выделением меди в виде металлического осадка. Таким образом, металл медь выделяется на катоде при электролизе раствора нитрата меди II.
Электролиз и его основные принципы
Электролиз представляет собой процесс, основанный на использовании электрического тока для преобразования химических соединений. Этот процесс происходит в электролизере, где происходит разделение соединения на ионы и их перенос к аноду и катоду под действием электрического поля.
В электролизе обязательно присутствуют два электрода: анод и катод. Анод - это положительно заряженный электрод, к которому при электролизе притягиваются отрицательно заряженные ионы, или анионы. Катод - отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы, или катионы.
Принцип электролиза основан на двух основных законах: законе Нернста и законе Фарадея. Закон Нернста устанавливает, что интенсивность процесса электролиза зависит от концентрации реагентов и от температуры. Закон Фарадея устанавливает пропорциональность между количеством прошедшего через электролит заряда и количеством выделившихся на электродах веществ.
Электролиз является важным процессом в химии, поскольку позволяет проводить различные химические реакции с высокой степенью контроля. Он используется в различных областях, таких как производство металлов, электрохимические синтезы, очистка воды, а также в аналитической химии для определения содержания веществ в образцах.
Роль катода в электролизе

Катод является одним из ключевых элементов в электролизе, играющим важную роль в процессе выделения металла на поверхности. Он представляет собой электрод, который приводится в отрицательный потенциал, притягивая положительно заряженные ионы металла. При этом на катоде происходит восстановление ионов к металлу.
Основная функция катода в электролизе заключается в принятии электронов, которые передаются через внешнюю цепь от анода. На поверхности катода происходит процесс редукции, при котором положительно заряженные ионы металла превращаются в нейтральные атомы или молекулы и оседают на поверхности катода в виде металлического отложения.
Катод является местом активного выделения металла при электролизе. Он служит контактной площадкой, на которой происходит осаждение и рост металлических частиц. Кроме того, катод способствует равномерному осаждению металла на поверхности и предотвращает его растворение в растворе.
Работа катода в электролизе напрямую зависит от его материала и состояния поверхности. Чистота и гладкость поверхности катода играют важную роль, так как определяют качество и равномерность осаждения металла. Использование специальных покрытий на катоде также может повысить эффективность процесса электролиза.
Итак, катод является неотъемлемой частью электролизного процесса, обеспечивая выделение металла на своей поверхности. От его состояния и свойств зависит эффективность процесса и качество получаемого металлического отложения.
Специфика электролиза нитрата меди II
Электролиз нитрата меди II является одним из способов получения металлической меди из ее соединений. В ходе этого процесса происходит переход электрического тока через водный раствор нитрата меди II, что приводит к разложению составляющих его ионов на катоде и аноде.
На катоде, под воздействием отрицательного заряда, происходит восстановление катионов меди (Cu2+) в атомарную форму меди (Cu). Это процесс сопровождается осаждением меди на поверхности катода в виде металлического покрытия.
Специфика электролиза нитрата меди II заключается в том, что вода, находящаяся в растворе нитрата меди II, подвергается электролизу, а не сам нитрат меди II. Это связано с тем, что нитратные ионы не подвержены восстановлению при электролизе и остаются в растворе в виде нитрат-анионов.
Важно отметить, что при электролизе нитрата меди II важную роль играет концентрация раствора. Слишком высокая концентрация нитрата меди II может привести к образованию прочного осадка из меди на катоде, что затруднит процесс электролиза. Снижение концентрации раствора до минимального уровня, при котором электролиз может протекать, позволяет получить качественное и равномерное осаждение меди на катоде.
Химический состав нитрата меди II
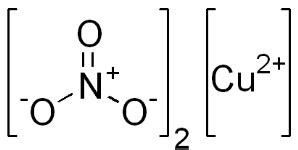
Нитрат меди II является химическим соединением, содержащим медь в ионной форме. Его химическая формула Cu(NO3)2 указывает на присутствие двух ионов нитрата (NO3-) в соединении. Медь в этом соединении имеет валентность II и находится в ионной форме – Cu2+.
Нитраты – это соли, содержащие анион нитрата (NO3-). В случае нитрата меди II, этот анион связывается с двуми ионами меди II. Ионы нитрата, в свою очередь, обеспечивают электрическую нейтральность соединения.
Химический состав нитрата меди II позволяет ему проявлять определенные свойства. На основе этого соединения можно проводить электролиз и получать медь на катоде. Именно на катоде при электролитическом разложении нитрата меди II и происходит выделение металла – меди.
Таким образом, химический состав нитрата меди II определяет его способность к электролизу и выделению меди на катоде. Это соединение является важным компонентом многих химических процессов и имеет широкое применение в различных областях науки и промышленности.
Процесс выделения металла на катоде
Процесс выделения металла на катоде является одним из основных методов получения металлов из их соединений. В данном случае рассматривается электролиз водного раствора нитрата меди II.
Электролиз осуществляется настолько, чтобы на катоде − электроде, к которому подключается отрицательный полюс ионный ток − происходило выделение металла. В данной реакции на катоде выделяется медь, причем она покрывает поверхность катода равномерно.
Процесс выделения металла на катоде связан с протеканием во внешней схеме электролиза электрического тока. При этом ионы металла, находящиеся в водном растворе, притягиваются к катоду под действием отрицательной полярности, а затем присоединяются к поверхности катода. Таким образом, происходит выделение металла на поверхности катода.
В выделенном состоянии металл обладает блеском и металлическими свойствами, такими как электропроводность и теплопроводность. Полученная медь на катоде можно использовать в различных целях, например, для производства электрических проводов или ювелирных изделий.
Использование нитрата меди II в промышленности

Нитрат меди II (Cu(NO3)2) является одним из наиболее распространенных соединений меди, используемых в различных отраслях промышленности.
В первую очередь, нитрат меди II применяется в производстве различных видов кабелей и проводов. Это связано с тем, что медь является отличным электропроводником, обладает высокой электропроводностью. Однако медь имеет свойство быстро окисляться на воздухе, что снижает ее электропроводность. Добавление нитрата меди II в процессе производства кабелей и проводов позволяет предотвратить окисление меди, обеспечивая стабильность и высокую электропроводность.
Кроме того, нитрат меди II активно используется в процессе гальванического покрытия металлами. Он служит источником ионов меди, необходимых для образования медного покрытия на различных поверхностях. Такое покрытие обеспечивает защиту от коррозии и придает предметам эстетически привлекательный внешний вид.
Кроме того, нитрат меди II применяется в химической промышленности для получения других соединений меди. Например, из нитрата меди II можно получить сульфат меди, хлорид меди и другие химические соединения, которые активно используются в различных отраслях промышленности.
Таким образом, нитрат меди II является важным сырьем для производства различных товаров и материалов, используемых в промышленности. Его свойства и химические реакции позволяют создавать электропроводящие материалы, защищать поверхности от коррозии и получать другие ценные химические соединения меди.
Применение меди и ее соединений
Медь и ее соединения имеют широкое применение в различных отраслях промышленности и науки.
Одним из основных применений меди является ее использование в производстве электротехнических изделий. Медные провода и кабели обладают высокой электропроводностью и теплопроводностью, что позволяет использовать их в электрической промышленности, транспорте и строительстве.
Также медь активно применяется в производстве металлургического оборудования, например, в виде медных тиглей и кипятильников. Это связано с высокой устойчивостью меди к коррозии и ее способностью выдерживать высокие температуры.
Медь и ее соединения также используются в производстве различных сплавов. Например, сплавы меди с цинком (латунь) широко применяются в машиностроении и строительстве, а сплав меди с оловом (бронза) используется для изготовления подшипников и пружин.
Благодаря своим антимикробным свойствам, медь и ее сплавы также применяются в медицине. Они используются для изготовления медицинских инструментов, имплантатов и поверхностей, которые должны быть стерильными и защищены от роста бактерий.
Кроме того, медные соединения нашли применение в производстве красок, керамики, стекла и других материалов. Они способны придавать особые свойства материалам, такие как цветность, электропроводность или устойчивость к износу.
В целом, медь и ее соединения являются важными материалами с множеством применений в различных сферах деятельности человека. Их уникальные свойства делают их неотъемлемой частью современного мира и технологического прогресса.
Вопрос-ответ
Как происходит электролиз водного раствора нитрата меди II?
При электролизе водного раствора нитрата меди II на катоде выделяется медь. В процессе электролиза происходит разложение нитрата меди II на ионы меди (Cu2+) и ионы нитрата (NO3-). Ионы меди притягиваются к катоду (отрицательному электроду), где получают электроны и переходят в металлическую форму, образуя пластинку меди. Одновременно с этим на аноде (положительном электроде) происходит окисление ионов нитрата, что ведет к образованию кислорода и выделению газовой стадии.
Какие условия необходимы для электролиза водного раствора нитрата меди II?
Для электролиза водного раствора нитрата меди II необходимы следующие условия: наличие электролита (водного раствора нитрата меди II), наличие двух электродов - катода (отрицательного электрода) и анода (положительного электрода), проводящая среда (обычно вода или другой растворитель), источник постоянного электрического тока (например, батарея или генератор). Также необходимо наличие внешней цепи, которая связывает анод и катод и позволяет протекать электрическому току.
Какие продукты получаются при электролизе водного раствора нитрата меди II?
При электролизе водного раствора нитрата меди II на катоде (отрицательном электроде) выделяется медь. При этом на аноде (положительном электроде) происходит окисление ионов нитрата, что приводит к образованию кислорода и выделению газовой стадии. Таким образом, основными продуктами электролиза водного раствора нитрата меди II являются медь и кислород.
Какова реакция осаждения меди на катоде при электролизе водного раствора нитрата меди II?
Реакция осаждения меди на катоде при электролизе водного раствора нитрата меди II выглядит следующим образом: ионы меди (Cu2+) + 2 электрона → медь (Cu). То есть, ионы меди в медновой соли получают электроны на катоде и переходят в металлическую форму, осаждаются на поверхности катода и образуют пластинку меди.
